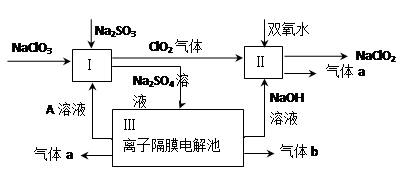-
海水中溶解和悬浮着大量的无机物和有机物,具有巨大的开发潜力,人类除了从海水中获得食盐和水外,还获得大量的钾、镁、溴、碘等,以下说法正确的是( )
A.用有机溶剂可萃取海水中的溴、碘
B.海水中含有碘元素,只需将海水中的碘升华就可以得到碘单质
C.常用电解氯化钠和氯化镁的水溶液来分别制得钠和镁
D.从海水中可以得到NaCl,NaCl可作为制造化肥的原料
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.7.8 gNa2S固体和7.8 gNa2O2固体中含有的阴离子数目均为0.1 NA
B.0.1mol·L-1的NaHSO4溶液中含有阳离子的物质的量为0.2mol
C.常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积约为2.24 L
D.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.用氯化铁溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+
B.Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
C.用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O
D.往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:
Al3+ + 2SO42- + 2Ba2+ + 4OH-== AlO2-+ 2BaSO4↓+ 2H2O
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,可能大量共存的是( )
①溶有足量氨气的无色溶液中:K+,NH
,Na+,HSO
,PO
,MnO
②能使pH试纸变深蓝色的溶液中:K+,Na+,AlO
,NO
,S
,SO
③水电离的H+浓度c(H+)=10-13mol·L-1的溶液中:Cl
,CO
,S2O
,Fe3+,K+,Na+
④加入Al能放出H2的溶液中:Na+,NH
,K+,SO
,Cl
,Br
⑤使石蕊变红的溶液中:Fe3+,Na+,K+,NO
,SO
,Cl
⑥室温下下pH=1的溶液中:Fe2+,Al3+,K+,Na+,NO
,I
,Cl
,S
⑦含有大量Fe3+的溶液:K+,NH
,Na+,SCN
,I
,Br
⑧室温下,
=0.1 mol/L的溶液中:Na+,K+,SO
,SiO
,NO
A.①③④⑥ B.①③⑥⑦ C.②④⑤⑧ D.②⑤⑦⑧
难度: 困难查看答案及解析
-
一定量碳酸氢钠与过氧化钠的混合物在密闭体系中充分加热后,排出气体,固体残留物组成不可能是( )
A.NaOH和Na2CO3 B.Na2O2、NaOH和Na2CO3
C.NaOH D.Na2CO3
难度: 中等查看答案及解析
-
在下列各溶液中通入足量CO2气体,最终有浑浊产生的( )
①饱和Na2CO3溶液;②澄清石灰水;③Ca(ClO)2溶液;④CaCl2溶液;⑤Na2SiO3溶液;⑥NaAlO2溶液
A.全部 B.除①④外 C.除①②③④外 D.除②③④外
难度: 中等查看答案及解析
-
下列说法不正确的是( )
①将SO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②将盐酸、KSCN 溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
⑤使用明矾可以对水进行消毒、杀菌
A.只有② B.①②③⑤ C.①③④⑤ D.①②③④
难度: 中等查看答案及解析
-
下列物质与其用途完全符合的有( )条
①CaCO3—制玻璃; ② SiO2—制光导纤维; ③AgBr—照相底片感光剂;
④NaCl—制纯碱; ⑤ Al2O3—焊接钢轨; ⑥NaClO—消毒剂;
⑦Fe2O3—红色油漆; ⑧MgO—耐火材料
A.5 B.6 C.7 D.8
难度: 中等查看答案及解析
-
Inorganic Syntheses一书中,有一如下图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是( )
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
难度: 中等查看答案及解析
-
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,化学式是NaAl(OH)2CO3关于该物质的说法正确的是( )
A.该物质是Al(OH)3和Na2CO3的混合物
B.1 mol NaAl(OH)2CO3最多可消耗4 mol H+
C.该药剂遇胃酸不产生气体,适合胃溃疡患者服用
D.该物质属于两性氢氧化物
难度: 中等查看答案及解析
-
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
( )
A.1∶1∶2 B.2∶1∶3 C.6∶3∶2 D.3∶2∶1
难度: 中等查看答案及解析
-
有一澄清透明溶液,只可能含有大量H+、Fe3+、Fe2+、Al3+、AlO2-、CO32-、NO3-七种离子中的几种,向溶液中逐滴加入一定量1mol/L的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失.下列判断正确的是( )
A.一定不含Fe3+和Fe2+
B.一定含有Fe3+ ,但一定不含Fe2+
C.溶液可能含有NO3-
D.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有
难度: 中等查看答案及解析
-
下图表示从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法中合理的是( )
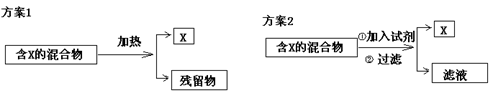
A.可以选用方案1分离碳酸氢钠的中含有的氯化铵
B.方案1中残留物应该具有受热易挥发的性质
C.方案2中加入的试剂一定能够与除X外的其它物质发生化学反应
D.方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3
难度: 中等查看答案及解析
-
将9.0 g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8 g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
A.原混合物中铜和铁各0.075mol
B.稀硝酸的物质的量浓度为0.5mol·L-1
C.第一次剩余4.8g金属为铜和铁
D.再加入上述100mL稀硝酸,又得到标准状况下1.12L NO
难度: 中等查看答案及解析
-
向含1 mol HCl和l mol MgSO4的混合溶液中加入1 mol/L的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )
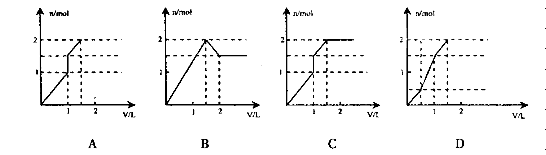
难度: 中等查看答案及解析
-
足量铜粉与一定量的浓硝酸充分反应,得到硝酸铜溶液和 NO2、N2O4、NO 的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好沉淀完全,则消耗 NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
难度: 中等查看答案及解析