-
一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.2g,若其中水的质量为10.8g。则CO的质量是
A.2.1g B.2.6g C.3.8g D.5.1g
难度: 困难查看答案及解析
-
下列物质中,属于弱电解质的是
A.氯化氢 B.碳酸氢钠 C.一水合氨 D.二氧化硫
难度: 简单查看答案及解析
-
下列分离方法中,和物质的溶解度无关的是
A.萃取 B.纸上层析 C.过滤 D.蒸馏
难度: 简单查看答案及解析
-
、
是氧元素的两种原子,下列说法正确的是
A.
和
的物理性质相同、化学性质不相同
B.通过化学反应可实现
与
之间相互转化
C.
和
的原子核外电子排布的方式不相同
D.
和
能形成三种化学性质相同的氧分子
难度: 简单查看答案及解析
-
关于羟基的说法正确的是
A.羟基可以电离成
和
B.1mol羟基共有9mol电子
C.与氢氧根离子是类别异构 D.羟基只存在于分子晶体中
难度: 简单查看答案及解析
-
下列有关侯氏制碱法的描述正确的是
A.该反应条件下,碳酸氢钠难溶于水 B.氨气和二氧化碳均来自合成氨工厂
C.侯氏制碱法实现了对氨气循环利用 D.生产时,应先通二氧化碳再通氨气
难度: 简单查看答案及解析
-
下列排列顺序不正确的是
A.原子半径:Si>Na>O B.热稳定性:HF>HCl>H2S
C.碱性:CsOH>KOH>NaOH D.失电子能力:K>Na>Mg
难度: 中等查看答案及解析
-
如图所示,集气瓶内充满某混合气体,置于光亮处一段时间后,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,则集气瓶内气体是
①CO、O2 ②C12、CH4 ③NO2、O2 ④N2、H2

A.①② B.②④ C.②③ D.③④
难度: 困难查看答案及解析
-
下列物质的制备线索中,不符合工业生产实际的是
A.NH3
NO
HNO3
B.浓缩海水
Br2
Br2(粗产品)
Br2
C.MnO2
Cl2
漂白粉
D.石油
乙烯
聚乙烯
难度: 简单查看答案及解析
-
某一兴趣小组准备在实验室中制H2,装置如图所示。可是在实验室中发现酸液不足。为达到实验目的,则可以从长颈漏斗中加入下列试剂中的

A.NaNO3溶液 B.四氯化碳 C.苯 D.Na2CO3溶液
难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式
(i) I2(g)
H2(g)
2HI(g)
9.48kJ
(ii) I2(s)
H2(g)
2HI(g)
26.48kJ
下列判断正确的是
A.254g I2(g)中通入2g H2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 中等查看答案及解析
-
黑火药爆炸时可发生如下反应:4S
16KNO3
16C → 3K2SO4
4K2CO3
K2S
12CO2↑
8N2↑,下列有关说法正确的是
A.KNO3只发生氧化反应 B.反应消耗12g C时电子转移5mol
C.还原产物只有K2S和 N2 D.被氧化与被还原的S为
难度: 中等查看答案及解析
-
从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是
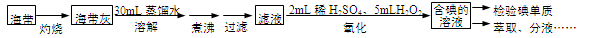
A.灼烧过程中使用的玻璃仪器有酒精灯、坩埚、玻璃棒
B.氧化过程中发生反应的离子方程式为:2I-
H2O2 → I2
2OH-
C.检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明有碘单质
D.分液时,先打开活塞放出下层液体,再关闭活塞倒出上层液体
难度: 中等查看答案及解析
-
pC类似pH,是指稀溶液中溶质物质的量浓度的负对数。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下,任何电解质的稀溶液中,pC(H+)
pC(OH-)
B.0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大
C.0.01mol/L的BaCl2 溶液中,pC(Cl-)
2pC(Ba2+)
D.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小
难度: 中等查看答案及解析
-
向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag+ +2NH3
H2O
[Ag(NH3)2]
+ 2H2O。下列分析不正确的是
A.浊液中存在沉淀溶解平衡:AgCl(s)
Ag+ (aq)
Cl- (aq)
B.实验可以证明NH3结合Ag+能力比Cl-强
C.实验表明实验室可用氨水洗涤银镜反应后的试管
D.由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
难度: 中等查看答案及解析
-
向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是
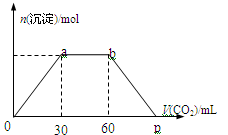
A.原混合物中n[Ba(OH)2]
n [NaOH]=1:2
B.横坐标轴上p点的值为90
C.b点时溶质为NaHCO3
D.ab段发生反应的离子方程式依次为:CO2+2OH-→ H2O+CO32-,CO2
H2O+ CO32-→2HCO3-
难度: 困难查看答案及解析
-
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜。当两装置电路中通过的电子都是1mol时,下列说法不正确的是

A.溶液的质量减小程度:乙<甲
B.溶液的导电能力变化:甲>乙
C.甲中阴极和乙中镁电极上析出物质质量:甲=乙
D.电极反应式:甲中阳极:
-2e → Cl2↑,乙中正极:
+ 2e → Cu
难度: 中等查看答案及解析
-
某澄清透明溶液中,可能大量存在下列离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Br-、AlO2-、Cl-、SO42-、CO32-,现进行如下实验:
①用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
②在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
③在第2份溶液中加入新制的氯水和CCl4,振荡后静置,下层溶液显橙红色。
则下列推断正确的是:
A.溶液中一定有
、
、
、
B.溶液中一定没有
、
、
、
C.不能确定溶液中是否有
、
、
D.往第3份溶液中滴加BaCl2可确认是否有
难度: 困难查看答案及解析
-
实验室进行:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,反应因硫酸浓度下降而停止。为测定反应残余液中硫酸的浓度,探究小组同学设计了4组实验方案(将残余液稀释至1L,每次均量取20mL稀释液进行实验),其中可行的是
A.加入足量BaCl2溶液反应,过滤、洗涤、干燥、恒重,称得固体质量为W1 g
B.加入过量的W2 g Zn充分反应后,过滤、洗涤、干燥、恒重,称得固体质量为W3 g
C.加入过量的W4 g CaCO3反应停止后,过滤、洗涤、干燥、恒重,称得固体质量为W5 g
D.滴入适当指示剂,用已知浓度的NaOH溶液进行滴定,消耗NaOH溶液的的体积为V mL
难度: 困难查看答案及解析
-
25℃时,100mL 0.1mol/L的三种盐溶液NaX、NaY、NaZ,pH分别为7、8、9。下列说法正确的是
A.相关微粒浓度关系:c(X-)
c(Y-)
c(HY)
c(Z-)
c(HZ)
B.三种溶液所含阴阳离子的总数依次减小
C.三种溶液均加水稀释到1000mL,pH分别变为8、9、10
D.HX、HY、HZ的酸性依次增强,电离平衡常数依次减小
难度: 中等查看答案及解析
-
下图为常温下用0.1000mol
NaOH溶液滴定20.00mL 0.1000mol
盐酸和20.00mL 0.1000mol
醋酸的曲线。若以HA表示酸,下列判断和说法正确的是

A.上左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c(
)
c(
)
C.B点时,反应消耗溶液体积:V(NaOH)<V(HA)
D.当0mL<V(NaOH) <20.00mL时,两溶液中各离子浓度大小顺序一定均为c(
)>c(
)>c(
)>c(
)
难度: 中等查看答案及解析
-
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为:2FeCl3
Cu → 2FeCl2
CuCl2)。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液及其形成的判断正确的是
A.c(
)︰c(
)
B.c(
)︰c(
)
C.c(
)
6mol/L,c(
)
0.6mol/L
D.该绝缘板腐蚀后质量减少0.384g
难度: 困难查看答案及解析