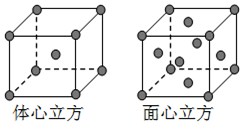
-
在d轨道中电子排布成
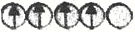 ,而不排布成
,而不排布成 ,其直接的根据是( )
,其直接的根据是( )A.能量最低原理 B.洪特规则 C.原子轨道能级图 D.泡利不相容原理
难度: 中等查看答案及解析
-
具有下列电子排布式的原子中,半径最大的是( )
A.1s22s22p63s23p3 B.1s22s22p3
C.1s22s22p4 D.ls22s22p63s23p4
难度: 中等查看答案及解析
-
下列分子或离子中,含有孤对电子的是( )
A.SiH4 B.CH4 C.H2O D.NH4+
难度: 中等查看答案及解析
-
有机化合物有不同的分类方法,下列说法正确的是( )
①从组成元素分:烃,烃的衍生物
②从分子中碳骨架形状分:链状有机化合物,环状有机化合物
③从官能团分:烯烃、炔烃、芳香烃、卤代烃、醇、酚、醛、羧酸、酯等
A.①③ B.①②③ C.①② D.②③
难度: 中等查看答案及解析
-
下列分子为直线形分子且分子中原子都满足8电子稳定结构( )
A.BeF2 B.C2H4 C.SO2 D.CO2
难度: 中等查看答案及解析
-
下列说法中错误的是( )
A.SiH4的空间构型是正四面体
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.原子晶体中原子以共价键结合,具有键能大、硬度大的特性
D.SO2、SO3都是极性分子
难度: 中等查看答案及解析
-
下列各组晶体类型完全不一样的一组是( )
A.CaO、NO、CO B.CO2、SiO2、NaC1
C.CC14、H2O2、He D.CH4、O2、Na2O
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.甲烷的球棍模型:

B.羟基的电子式:
C.乙醛的结构式:CH3CHO
D.乙酸的结构简式:C2H4O2
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.原子晶体中只含有共价键,离子晶体中只含有离子键
B.原子晶体的熔点一定比金属晶体的高
C.分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键
D.任何晶体中,若含有阳离子就一定含有阴离子
难度: 中等查看答案及解析
-
下列配合物的水溶液中加入硝酸银不能生成沉淀的是( )
A.[Co(NH3)4C12]Cl B.[Co(NH3)3C13]
C.[Co(NH3)6]Cl3 D.[Cu(NH3)4]C12
难度: 中等查看答案及解析
-
根据等电子原理,等电子体之间结构相似、物理性质也相近。以下各组粒子不能互称为等电子体的是( )
A.CO和N2 B.N2H4和C2H4
C.CO2和N2O D.O3和SO2
难度: 中等查看答案及解析
-
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
A.直线形:三角锥形 B.V形;三角锥形
C.V形;平面三角形 D.直线形;平面三角形
难度: 中等查看答案及解析
-
下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiO2、CsCl、CF4、CBr4
B.CsCl、SiO2、CBr4、CF4
C.SiO2、CsCl、CBr4、CF4
D.CF4、CBr4、CsCl、SiO2
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是最外层有一个电子的金属且是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.元素W、X的氯化物中,各原子均满足8电子的稳定结构
B.元素X与氢形成的原子比为1:1的化合物有很多种
C.元素Z可与元素X形成共价化合物XZ2
D.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
难度: 困难查看答案及解析
-
下列说法错误的是( )
A.ⅦA元素的氢化物中氟化氢的沸点最高
B.第三周期元素形成的简单离子的半径随原子序数的增大依次增大
C.I2易溶于CCl4可以用相似相溶原理解释
D.CH2=CH2分子中共有5个σ键和1个π键
难度: 中等查看答案及解析
-
有一种有机物C4H4其分子结构如图所示,有关该分子说法正确的是
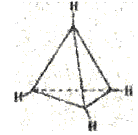
A.该分子是极性分子
B.每个碳原子均为sp2杂化
C.分子中有极性键和非极性键
D.分子中共有4个碳碳键
难度: 中等查看答案及解析
-
下列各项所述的数字不是6的是( )
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数
B.在二氧化硅晶体中,围成最小环的原子数
C.在金刚石晶体中,围成最小环的原子数
D.在CsCl晶体中,与一个Cs+最近的且距离相等的Cs+的个数
难度: 中等查看答案及解析
-
下列数据是对应物质的熔点,有关判断错误的是( )
Na2O
Na
AlF3
AlCl3
Al2O3
BCl3
CO2
SiO2
920℃
97.8℃
1291℃
190℃
2073℃
-107℃
-57℃
1723℃
A.含有金属阳离子的晶体不一定是离子晶体
B.在共价化合物分子中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
难度: 中等查看答案及解析
-
已知CsCl晶体的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为acm,如图所示,则CsCl的相对分子质量可以表示为( )
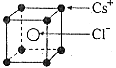
A.NA•a3•ρ B.
C.
D.
难度: 中等查看答案及解析