-
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子电子数比Y元素原子的L电子层上电子数少2个.则这三种元素所组成的化合物的化学式不可能是( )
A.XYZ3
B.X2YZ4
C.X3YZ4
D.X4Y2Z7难度: 中等查看答案及解析
-
下列说法中不正确的是( )
①质子数相同的粒子一定属于同种元素; ②同位素的性质几乎完全相同;
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子;
④电子数相同的粒子不一定是同一种元素; ⑤一种元素只能有一种质量数;
⑥某种元素的原子相对原子质量取整数,就是其质量数.
A.①②④⑤
B.③④⑤⑥
C.②③⑤⑥
D.①②⑤⑥难度: 中等查看答案及解析
-
下列各项所述的数字不是6的是( )
A.在NaCI晶体中,与一个Na+最近的且距离相等的CI-的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数难度: 中等查看答案及解析
-
下列各组分子中,都属于含极性键的非极性分子的是( )
A.CO2H2O2
B.C2H2CH4
C.P4 C2H4
D.NH3 HCl难度: 中等查看答案及解析
-
下列现象与氢键有关的是( )
①NH3的熔、沸点比VA族其他元素氢化物的高
②C原子个数小于4的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子在高温下也很稳定.
A.①②③④⑤⑥
B.①②③④⑤
C.①②③④
D.①②③难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A.含离子键的晶体不一定是离子晶体
B.含共价键的晶体不一定是分子晶体
C.含极性键的分子可能不是极性分子
D.含非极性键的分子不一定是非极性分子难度: 中等查看答案及解析
-
下列分子为直线形分子且分子中原子都满足8电子稳定结构( )
A.BeF2
B.C2H4
C.SO2
D.CO2难度: 中等查看答案及解析
-
甲醛分子式为CH2O,有强烈刺激性气味的气体,甲醛在常温下是气态,被世界卫生组织确定为致癌和致畸形物质.下列关于其结构及性质的分析正确的是( )
A.C原子采取sp3杂化,O原子采取sp杂化
B.甲醛分子中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构
C.甲醛分子与水分子间可以形成氢键,甲醛分子间不能形成氢键
D.甲醛分子为非极性分子难度: 中等查看答案及解析
-
“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一.下列说法合理的是( )
A.依据等电子原理N2O与SiO2分子具有相似的结构(包括电子式)
B.已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示
C.N2O与CO2互为等电子体,因此不含非极性键
D.N2O为三角形分子难度: 中等查看答案及解析
-
某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄色气体产生,则下列说法不正确的是( )
A.X2+具有还原性
B.X的+2价化合物比+4价化合物稳定
C.XO2具有强氧化性
D.该元素是第ⅡA族元素难度: 中等查看答案及解析
-
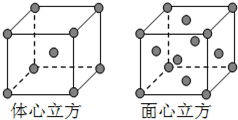
下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )

A.图(1)和图(3)
B.图(2)和图(3)
C.图(1)和图(4)
D.只有图(4)难度: 中等查看答案及解析
-
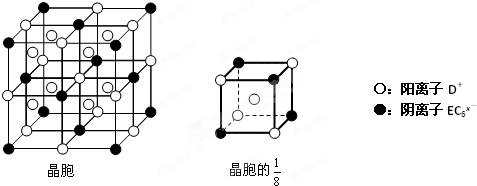
已知CsCl晶体的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )
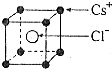
A.
B.
C.
D.难度: 中等查看答案及解析
-
Rm+与Xn-具有相同的电子层结构,则两种微粒半径大小关系为( )
A.前者大于后者
B.前者小于后者
C.前者等于后者
D.不能确定难度: 中等查看答案及解析
-
下列各微粒不属于等电子体的是( )
A.NO2+和 CO2
B.CO32-和 SO2
C.O3和NO2-
D.SO42-和PO43-难度: 中等查看答案及解析
-
原子序数小于18的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是( )
A.XO4-
B.XO32-
C.XO42-
D.XO43-难度: 中等查看答案及解析
-
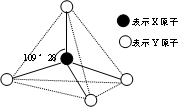
一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为( )

A.TiC
B.Ti13C14
C.Ti4C7
D.Ti14C13难度: 中等查看答案及解析
-
下列各项叙述中,正确的是( )
A.电子层序数越大,s原子轨道的形状相同、半径越小
B.在同一电子层上运动的电子,其自旋方向肯定不同
C.镁原子由1s22s22p63s2→ls22s22p63p2时,原子吸收能量,由基态转化成激发态
D.原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解难度: 中等查看答案及解析
-
下列现象和应用与电子跃迁无关的是( )
A.激光
B.焰色反应
C.原子光谱
D.石墨导电难度: 中等查看答案及解析
-
氮化硼是一种新合成的结构材料,它是超硬、耐磨,耐高温的物质,下列各组物质熔化时所克服的粒子间的作用与氮化硼熔化时所克服的粒子间作用相同的是( )
A.C60和金刚石
B.晶体硅和水晶
C.冰和干冰
D.碘和金刚砂难度: 中等查看答案及解析
-
氯化硼BCl3的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
A.氯化硼液态时能导电而固态时不导电
B.氯化硼中心原子采用sp杂化
C.三氯化硼遇水蒸气会产生白雾
D.氯化硼分子呈三角锥形,属极性分子难度: 中等查看答案及解析