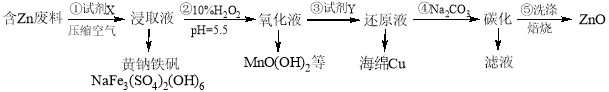
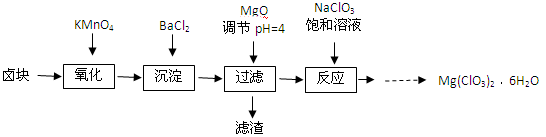
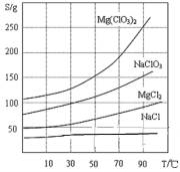
-
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关该反应的说法正确的是
A.NF3分子中所有原子共平面
B.NF3在反应中既做氧化剂又做还原剂
C.生成0.2mol HNO3时转移0.2mol电子
D.氧化产物与还原产物的物质的量之比为2∶1
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列说法中正确的是
A.100mL 1mol·L-1AlCl3溶液中含的阳离子数等于0.1NA
B.标准状况下,22.4L CCl4中含有的CCl4分子数为NA
C.将2mL 0.5mol·L-lNa2SiO3溶液滴入稀盐酸中制得H2SiO3胶体,所含胶粒数为0.001NA
D.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去的电子数为0.1NA
难度: 中等查看答案及解析
-
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.PH大于7的溶液:Na+、Ba2+、SO32-、ClO—
B.含有0.1 mol·L-1 Fe(NO3)2的溶液:H+、Mg2+、SCN-、Cl-
C.使酚酞试液变红色的溶液:Na+、Ba2+、I-、Cl-
D.由水电离产生的c(H+)=10-13mol·L-1的溶液:NH4+、SO42-、NO3-、Cl-
难度: 中等查看答案及解析
-
实验设计是化学实验的重要技能之一。用所给装置(夹持装置省略)完成相关实验,最合理的选项是
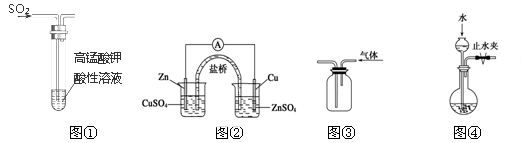
A.图①中KMnO4溶液紫红色褪去,说明SO2具有漂白性
B.图②能构成铜锌原电池
C.图③利用排空气法收集二氧化碳
D.图④检查装置气密性
难度: 中等查看答案及解析
-
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是
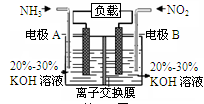
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
难度: 困难查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g) ⇌ 2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:

下列说法不正确的是
A.该温度下此反应的平衡常数K=1.44
B.其他条件不变,升高温度,反应达到新平衡前V(逆)< V (正)
C.反应前2 min的平均速率v (Z)=4.0×10-3mol/(L·min)
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
难度: 困难查看答案及解析
-
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.0.1mol·L-1NaHCO3溶液中的粒子浓度:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.将标况下2.24L的CO2通入150mL 1mol·L-1NaOH溶液中充分反应后的溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+2c(A-)=c(H+)+2c(HA)
难度: 极难查看答案及解析