-
分类是化学学习与研究的常用方法,下列分类正确的是( )
A.C
l2O7、P2O5、SO3、CO2均属于酸性氧化物
B.Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
难度: 简单查看答案及解析
-
下列叙述错误的是( )
A.10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49%
B.配制0.1mol/L的Na2CO3溶液480ml,需用500ml容量瓶
C.在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水
D.向两等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变)
难度: 简单查看答案及解析
-
已知NA为阿伏加德罗常数的值。有关草酸(HOOC-COOH)的下列说法中错误的是( )
A.9.0g草酸中共用电子对数目为0.9NA
B.9.0 g草酸被NaClO氧化生成CO2,转移的电子数为0.2 NA
C.9.0 g草酸溶于水,其中C2O42-和HC2O4-的微粒数之和为0.1NA
D.9.0g草酸受热完全分解为CO2、CO、H2O,标况下测得生成的气体体积为4.48 L
难度: 简单查看答案及解析
-
已知NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
B.在标况下,22.4LHF和22.4LC2H4原子个数比为1:3
C.将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D.0.1 mol H2O2分子中含极性共价键数目为0.3 NA
难度: 简单查看答案及解析
-
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、MnO
、CO
B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、SO
、NO
C.0.1
mol·L-1 NH4HCO3溶液中:K+、Na+、NO
、Cl-
D.0.1 mol·L-1 FeCl3溶液中:Fe2+、NH
、SCN-、SO
难度: 简单查看答案及解析
-
设NA为阿伏加罗常数的值,下列说法正确的是( )
A.1molMg在空气中完全燃烧生成MgO和Mg
3N2,转移的电子数为NA
B.14g分子式为CnH2n的链烃中含有的C—H键的数目为2NA
C.室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
D.Fe与水蒸汽反应生成22.4L氢气,转移电
子数为2NA
难度: 简单查看答案及解析
-
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是( )

A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B.b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
难度: 困难查看答案及解析
-
化学与人类生产、生活、社会可持续发展密切相关。下列有关说法正确的是( )
A.某地燃烧化石燃料排放的废气中含CO2、SO2,使雨水pH=6形成酸雨
B.水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C.高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应
D.人造纤维,合成纤维和光导纤维都是有机高分子化合物
难度: 简单查看答案及解析
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.还原剂与氧化剂的物质的量之比为1:4
B.氧气是氧化产物
C.若生成4.48 L HF,则转移0.8 mol电子
D.O2F2既是氧化剂又是还原剂
难度: 简单查看答案及解析
-
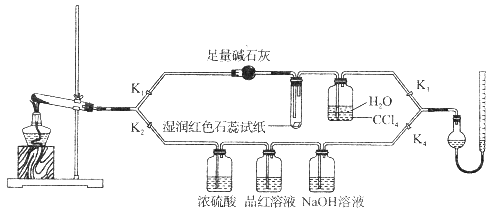
下列实验操作不正确或不能达到目的的是( )
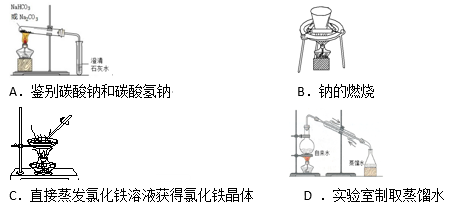
难度: 简单查看答案及解析
-
下列有关溶液中离子存在和转化的表达合理的是( )
A.向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
B.标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2—=Al(OH)3↓+HCO3-
C.由水电离出的c(H+)=1×10-12mol
/L的溶液中可能大量存在K+、I-、Mg2+、NO3-
D.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
难度: 简单查看答案及解析
-
某溶液中含有NH4+、Fe2+、Al3+、SO42-、Cl-五种离子,若向其中加入过量的Na2O2,微热并搅拌,再通入过量的HI气体,充分反应后,最后加入足量的硝酸酸化的硝酸钡溶液,则下列叙述不正确的是( )
A.反应后溶液中NH4+、Fe2+、SO42-的物质的量减少, Al3+、Cl-的物质的量不变
B.Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化
C.该实验中共有两种气体生成
D.Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解
难度: 中等查看答案及解析
-
某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5 mL0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生
气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g。
下列说法中正确的是:( )
A.该溶液中一定不含
Ba2+ 、Mg2+、A13+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液是否有K+ 需做焰色反应(透过蓝色钴玻璃片)
D.可能含有Cl-
难度: 困难查看答案及解析
-
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,可以发生如图转化,下列说法不正确的是( )
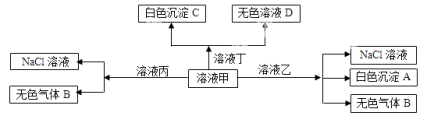
A.在甲中滴加丁可能发生反应:HCO3-+ Ba2++OH—= BaCO3↓+ H2O
B.溶液丙中还可以大量共存的离子有:I-、NO3-
、SO42-
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为 AlCl3
难度: 困难查看答案及解析
-
把7.2g铁粉投入40mL某HNO3溶液中,充分反应后剩余固体1.6g,产生NO2和NO的混合气体0.08mol。若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
A.3.5mol·L-1 B.4.5mol·L -1 C.7.0mol·L -1 D.9.0mol·L -1
难度: 简单查看答案及解析
-
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )
A.V=44.8
B.原样品中Fe元素的质量分数为38.89%
C.滤液A中的阳离子为Fe
2+、Fe3+、H+
D.样品中CuO的质量为4.0 g
难度: 困难查看答案及解析
-
硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:下列说法不正确的是( )
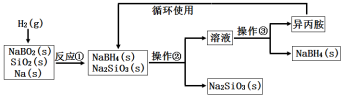
A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
B.操作②、操作③分别是过滤与蒸发结晶
C.反应①加料之前需将反应器加热至100℃以上并通入氩气
D.反应①中氧化剂与还原剂的物质的量之比为1∶2
难度: 简单查看答案及解析
-
向含有0.2molFeI2的溶液中加入a molBr2。下列叙述不正确的是( )
A.当a=0.1时,发生的反应为2I-+Br2=I2+2Br-
B.当a=0.25时,发生的反应为2Fe2++4I-+3Br2=2Fe3++2I2+6Br-
C.当溶液中I-有一半被氧化时,c(I-):c(Br-)=1:1
D.当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)=c(Br-)+c(OH-)
难度: 困难查看答案及解析
-
将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
操作
现象
A
加入NaOH溶液
有红褐色沉淀
B
加入Ba(NO3)2溶液
有白色沉淀
C
加入酸性KMnO4溶液
紫色褪去
D
加入K3[Fe(CN)6](铁氰化钾)溶液
有蓝色沉淀
难度: 简单查看答案及解析
-
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物:

下列说法错误的是
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
难度: 中等查看答案及解析