-
日常生活中的“加碘食盐”、“铁强化酱油”、“含氟牙膏”等商品。其中的碘、铁、氟应理解为
A.单质 B.元素 C.分子 D.氧化物
难度: 中等查看答案及解析
-
合金是一类用途广泛的金属材料。下列物质中属于合金的是
A.钢 B.氢氧化铝 C.金刚石 D.四氧化三铁
难度: 中等查看答案及解析
-
科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中正确的是
A.地壳中硅的含量稀少 B.自然界中存在大量单质硅
C.高纯度的硅可用于制造计算机芯片 D.光导纤维的主要成分是
难度: 中等查看答案及解析
-
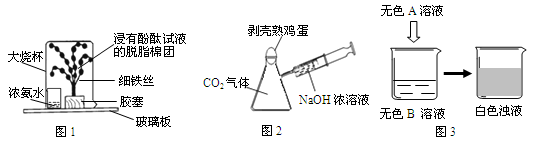
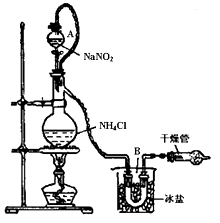
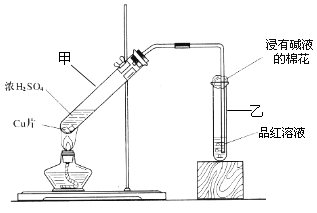
下图所示的实验操作,不能达到相应目的的是

难度: 中等查看答案及解析
-
C、N、S的氧化物中许多是工业上重要的化工原料,但是当它们分散到空气中时,会带来很多环境问题。下列有关这些元素的氧化物说法错误的是
A.开发太阳能、水能、风能、氢能等新能源将有利于减少这些元素的氧化物的产生
B.N与S的某些氧化物能直接危害人的身体健康,引发呼吸道疾病
C.“温室效应”与二氧化碳的排放有着直接的关系
D.这些氧化物使雨水的pH<7,我们把pH<7的雨水称之为酸雨
难度: 中等查看答案及解析
-
小明家中有如下生活用品:碘酒、食盐、食醋、84消毒液(有效成分为NaClO),小明利用上述用品不能完成的任务是
A.检验买来的奶粉中是否加有淀粉 B.检验自来水中是否含有Cl-
C.除去保温瓶中的水垢 D.洗去白色衣服上的番茄汁
难度: 中等查看答案及解析
-
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示:

下列有关该反应的叙述中正确的是
A.该反应是复分解反应
B.该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl
C.反应中Cl2既是氧化剂,又是还原剂
D.NaClO2和ClO2中Cl的化合价相同
难度: 中等查看答案及解析
-
下列反应中,硫元素表现出氧化性的是
A.稀硫酸与锌粒反应 B.二氧化硫与氧气反应
C.浓硫酸与碳反应 D.三氧化硫与水反应
难度: 中等查看答案及解析
-
下列叙述中错误的是
A.水的摩尔质量是18 g·mol-1 B.硫离子的结构示意图:
C.8个质子、10个中子的原子:
D.氦气分子式:He2
难度: 中等查看答案及解析
-
下列有关Na2CO3和NaHCO3性质的说法中,正确的是
A.热稳定性:Na2CO3<NaHCO3
B.相同温度下,在水中Na2CO3的溶解度小于NaHCO3
C.106gNa2CO3和84gNaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3
D.Na2CO3 和NaHCO3均可与澄清石灰水反应
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.铝与NaOH溶液反应:2Al+2H2O+2OH-=2AlO2-+3H2↑
B.将一小块钠投入水中:Na+H2O=Na++OH-+H2↑
C.碳酸钙和盐酸反应:CO32-+2H+ =CO2↑+H2O
D.利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+
难度: 中等查看答案及解析
-
下列说法正确的是(NA表示阿伏加德罗常数)
A.22.4L氯气与足量的钠反应,转移电子数为2 NA
B.常温常压下,32 g O3或O2中含有的氧原子数都为2 NA
C.1 mol氯气与足量NaOH溶液反应时,失去的电子数为2 NA
D.含2 mol H2SO4溶质的浓硫酸与足量铜反应,转移电子数为2 NA
难度: 中等查看答案及解析
-
向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)
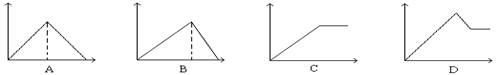
难度: 中等查看答案及解析
-
某溶液中存在较多的OH-、K+、CO32-,该溶液中还可能大量存在的是
A.H+ B.Ca2+ C.SO42- D.NH4+
难度: 中等查看答案及解析
-
下列说法错误的是
A.Fe在Cl2中燃烧能生成FeCl3
B.氯化氢气体与氨气相遇,有大量的白烟生成
C.向蔗糖中加入浓硫酸,浓硫酸主要表现出脱水性和强氧化性
D.过量的铜和少量的稀硝酸充分反应后,再加入一定量稀硫酸,剩余铜片的质量不变
难度: 中等查看答案及解析
-
以下化学反应的产物与反应物的浓度或者用量无关的是
A.AlCl3溶液中通入NH3 B.Cu与硝酸溶液反应
C.CO2通入NaOH溶液中 D.Na与O2反应
难度: 中等查看答案及解析
-
下列现象的描述正确的是
A.点燃的镁条伸人充满二氧化碳的集气瓶中,不能继续燃烧
B.常温下,铁与浓硝酸剧烈反应生成红棕色气体
C.铁制品在潮湿的空气中,能缓慢锈蚀成铁锈
D.钠在氯气中燃烧,产生黄绿色火焰并有白烟生成
难度: 中等查看答案及解析
-
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中大量存在的离子有
A.AlO2- B.Cu2+ C.Al3+ D.Mg2+
难度: 中等查看答案及解析
-
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法错误的是
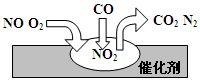
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应为2NO+O2+4CO
4CO2+N2
难度: 中等查看答案及解析
-
将7.5 g镁铝合金溶于90 mL 4 mol/L稀硫酸中,合金完全溶解,再加入240 mL 3 mol/L的NaOH溶液,得到沉淀的质量为19.4 g,则此时溶液中的溶质为
A.Na2SO4 B.Na2SO4、MgSO4和Al2(SO4)3 C.Na2SO4和MgSO4 D. Na2SO4和NaAlO2
难度: 中等查看答案及解析