-
化学与人类的生活,生产密切相关,下列说法中正确的是( )
A. 蚕丝和棉花的组成元素相同,结构不同,因而性质不同
B. 埃博拉病毒可用乙醇、次氯酸钠溶液、双氧水消毒,其消毒原理相同
C. 纯碱是属于碱类、谷氨酸一钠(C5H8NO4Na, 味精)属于盐类
D. 压缩天然气(CNG)、液化石油气(LPG)的主要成分是烃类,是城市推广的清洁燃料
难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是( )
A.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3+ + 7OH-=Al(OH)3↓+ AlO2- + 2H2O
B.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时Cu2++2HS-=CuS↓+H2S↑
C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2+ + 4Br- +3Cl2=2 Fe3+ + 2Br2 + 6Cl-
D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3 Fe +2NO3- +8H+=3Fe2+ +2NO↑+4H2O
难度: 困难查看答案及解析
-
下列装置应用于实验室制NO并回收硝酸铜的实验,能达到实验目的是( )
A. 用装置制取NO
 B. 用装置收集NO
B. 用装置收集NO 
C. 用装置分离炭粉和硝酸铜溶液
 D. 用装置蒸干硝酸铜溶液制Cu(NO3)2•3H2O
D. 用装置蒸干硝酸铜溶液制Cu(NO3)2•3H2O 
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是形成化合物数量众多,且分布极广的元素,X原子的最外层电子数是其电子层数的3倍,元素Y是地壳中含量最丰富的金属元素,Z元素的单质易溶于WZ2中。下列说法错误的是( )
A. 元素X、Y与Z的原子半径大小:Y>Z>X
B. 元素W、Z的氯化物中,化学键类型相同,且各原子均满足8电子
C. 元素X与元素Y形成的化合物是一种较好的耐火材料
D. 元素X可与元素Z可组成3种二价阴离子
难度: 中等查看答案及解析
-
下列项目判断,结论正确的是
选项
项目
结论
A
三种有机化合物:乙烷、氯乙烯、苯
分子内所有原子均在同一平面上
B
C4H8Cl2的同分异构体数目(不考虑立体异构)
共有10种
C
乙烯和苯都能使溴水褪色
褪色的原理相同
D
由乙酸和乙醇制乙酸乙酯,油脂水解
均属于取代反应
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是
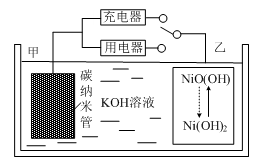
A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:
NiO(OH)+H2O+e-=Ni(OH)2+OH-
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH
2Ni(OH)2
难度: 简单查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A. 浓度均为0.1 mol•L﹣1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③<②<①
B. 工业上常用Na2SO3溶液作为吸收液脱除烟气中的SO2 ,随着SO2的吸收,吸收液的pH不断变化。当吸收液呈酸性时:c (Na+)=c (SO32﹣)+c (HSO3﹣)+c (H2SO3)
C. 常温下,将0.1 mol•L﹣1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CH3COO-)/c(CH3COOH)的值增大到原来的100倍
D. 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)
难度: 困难查看答案及解析
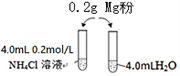

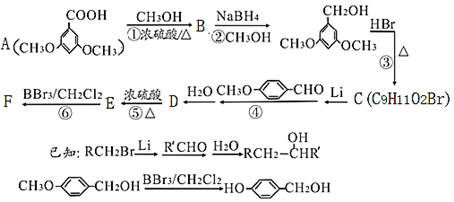
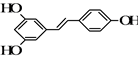 )是重要的化工原料,其一种合成路线如下:
)是重要的化工原料,其一种合成路线如下: