-
下列说法正确的是
A.摩尔是用来衡量微观粒子多少的一种物理量
B.在一定的温度和压强下,各种气体的摩尔体积相等
C.阿伏加德罗常数的数值是0.012 kg 14C所含的原子个数
D.若气体摩尔体积为22.4 L•mol﹣1,则所处条件为标准状况
难度: 简单查看答案及解析
-
分类是化学学习与研究的常用方法,下列分类正确的是
A.Na2O2、MgO、Al2O3均属于碱性氧化物
B.纯碱、烧碱、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如图所示
难度: 简单查看答案及解析
-
下列有关化学知识的叙述中正确的是
A.丁达尔效应是溶液和胶体的本质区别
B.碱性氧化物一定是金属氧化物
C.常用作水处理剂的KAl(SO4)2和漂白粉都是强电解质
D.232Th 转变成233U是化学变化,233U和235U的化学性质几乎相同
难度: 简单查看答案及解析
-
相同条件下,O4是意大利的一位科学家合成的一种新型的氧分子,一个分子由四个氧原子构成,振荡会发生爆炸,在相同条件下,关于等质量的O4和O3比较正确的是
A.所含原子数相等 B.密度之比1:1
C.体积之比1:1 D.分子数之比4:3
难度: 中等查看答案及解析
-
下列说法正确的是
A.金属单质在反应中只能作还原剂,非金属单质只能作氧化剂
B.失电子多的金属还原性强
C.某元素从化合态到游离态,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
难度: 简单查看答案及解析
-
某无色溶液能与铝反应放出氢气,则该溶液中肯定不能大量共存的离子组是
A.NH4+、Na+、Ba2+、Cl- B.Na+、I-、HCO3-、SO42-
C.K+、Cl-、SO32-、AlO2- D.Na+、Mg2+、SO42-、Cl-
难度: 简单查看答案及解析
-
下列是某同学对相应的离子方程式所作的评价,其中评价合理的是
编号
化学反应
离子方程式
评 价
A
碳酸钙与醋酸反应
CO32-+2CH3COOH =CO2↑+H2O+2CH3COO-
错误,碳酸钙是弱电解质,不应写成离子形式
B
NaAlO2溶液中通入过量CO2
2AlO2-+CO2+3H2O==2Al(OH)3↓+CO32-
正确
C
NaHCO3的水解
HCO3-+H2O
CO32-+H3O+
错误,水解方程式误写成电离方程式
D
等物质的量的FeBr2和Cl2反应
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl -
错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符
难度: 困难查看答案及解析
-
下列说法中正确的是
A.由不同原子构成的纯净物一定是化合物 B.非金属氧化物一定是酸性氧化物
C.含金属元素的离子一定都是阳离子 D.胆矾是纯净物,水泥是混合物
难度: 简单查看答案及解析
-
用36.5%的浓盐酸(密度1.2 g·cm-3)配1 mol·L-1的稀盐酸 100 mL,配制过程需用到的仪器组合正确的是①100 mL量筒 ②10 mL量筒 ③50 mL 烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥ C.③⑤⑦⑥① D.④③⑦⑤⑥
难度: 中等查看答案及解析
-
已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液。下列判断不正确的是
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明氧化性:Cr2O72->I2
D.实验③证明H2O2既有氧化性又有还原性
难度: 困难查看答案及解析
-
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O = 7X+5FeSO4+12H2SO4,下列说法正确的是
A.X的化学式为CuS,它既是氧化产物又是还原产物
B.5 mol FeS2发生反应,有10 mol电子转移
C.产物中的SO42-离子有一部分是氧化产物
D.FeS2只作还原剂
难度: 困难查看答案及解析
-
将溶液(或气体)X逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的质量与加入X的物质的量关系如图所示,符合图中情况的一组物质是
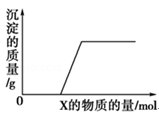
X
Y溶液
A
Ba(HCO3)2溶液
NaOH溶液
B
KOH溶液
Mg(HSO4)2溶液
C
Na2CO3溶液
CaCl2溶液
D
CO2气体
石灰水
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
室温时,能大量共存于同一溶液中,且当加入另一种强电解质使水电离出的c(H+)=1×10﹣13 mol/L时又一定能发生反应的离子组是
①Na+、Ba2+、Cl﹣、HCO3﹣ ②K+、NH4+、CH3COO﹣、SO42﹣
③Ca2+、Cu2+、NO3﹣、SO32﹣ ④Fe3+、Na+、SCN﹣、Cl﹣
⑤Al3+、Na+、HCO3﹣、NO3﹣ ⑥Fe2+、Na+、NO3﹣、I﹣
⑦Ag+、NH4+、OH﹣、NO3﹣ ⑧Na+、K+、CH3COO﹣、NO3﹣.
A.①②⑥ B.②③⑥ C.①④⑧ D.③⑤⑦
难度: 困难查看答案及解析
-
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:
K(H2CO3)>K(HClO)>K(HCO3-)>K[Al(OH)3];则下列相关离子方程式正确的是
A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+
B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
C.“84”消毒液(主要成分为NaClO)露置在空气中变质: 2ClO-+CO2+H2O=CO32-+2HClO
D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH-
难度: 困难查看答案及解析
-
若以w1和w2分别表示物质的量是浓度为c1 mol/L和c2 mol/L氨水溶液的质量分数,已知2w1=w2,则下列推断正确的是(已知氨水的密度小于纯水的密度)
A.2c1=c2 B.2c2=c1 C.c2>2c1 D.c1<c2<2c1
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,22.4L三氯甲烷中共价键数目为4NA
B.1mol碳烯(:CH2)所含电子总数为10NA
C.6.4gCaC2晶体中含有阴阳离子总数为0.2NA
D.1 mol CO2与含2 mol NaOH的溶液反应后,溶液中CO32-数为NA
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项错误的是
序列
参加反应的物质
生成物
①
KMnO4 、H2O2 、H2SO4
K2SO4 、MnSO4……
②
Cl2 、FeBr2
FeCl3 、FeBr3
③
MnO4- ……
Cl2 、Mn2+……
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4-> Cl2 > Fe3+> Br2
难度: 困难查看答案及解析
-
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A.硫元素在此过程中仅被还原
B.氧化剂与还原剂的物质的量之比为1:2
C.每生成1molNa2S2O3,转移4mo l电子
D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2
难度: 中等查看答案及解析
-
下列物质分类的正确组合是
选项
碱
酸
盐
酸性氧化物
A
纯碱
盐酸
烧碱
二氧化硫
B
烧碱
硫酸
食盐
一氧化碳
C
氨水
醋酸
石灰石
二氧化碳
D
苛性钾
碳酸
胆矾
三氧化硫
难度: 中等查看答案及解析
-
在两个密闭容器中,分别充满等物质的量的甲、乙两种气体,它们的温度和摩尔质量均相同。试根据甲、乙的密度(ρ)的关系,下列说法中正确的是
A.若ρ(甲)>ρ(乙),则气体体积:甲<乙
B.若ρ(甲)>ρ(乙),则分子数:甲>乙
C.若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙
D.若ρ(甲)<ρ(乙),则气体的压强:甲>乙
难度: 中等查看答案及解析
-
某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42﹣,CO32﹣等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列判断正确的是
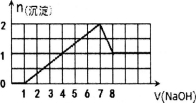
A.原溶液中一定含有H+、Fe3+、Al3+,可能含Ba2+
B.原溶液中含Fe3+和Al3+,物质的量之比为l:l
C.原溶液中可能含有CO32﹣
D.反应最后形成的溶液中含有的溶质只有NaAlO2
难度: 中等查看答案及解析
-
现将1mo1Cu2S与144克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2 、CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为
A.4 mo1 B.5 mo1 C.6 mo1 D.7 mo1
难度: 中等查看答案及解析