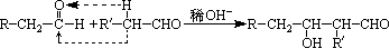-
下列反应不属于氧化还原反应的是
A.锌放入稀硫酸中 B.高锰酸钾分解
C.实验室制备氨气 D.碳和水蒸气在高温下反应
难度: 中等查看答案及解析
-
关于胶体和溶液的区别,下列叙述中正确的是
A.溶液呈电中性,胶体带有电荷
B.溶液中溶质微粒一定不带电,胶体中分散质微粒带有电荷
C.溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸
D.溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光带
难度: 简单查看答案及解析
-
下列表中对于相关物质的分类全部正确的一组是
编号
纯净物
混合物
弱电解质
非电解质
A
明矾
蔗糖
NaHCO3
CO2
B
天然橡胶
石膏
SO2
CH3CH2OH
C
冰
王水
H2SiO3
Cl2
D
胆矾
玻璃
H2CO3
NH3
难度: 中等查看答案及解析
-
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是
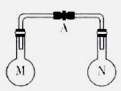
编号
①
②
③
④
气体M
H2S
H2
NH3
NO
气体N
SO2
Cl2
HCl
O2
A.①②③④ B.②④①③ C.④①②③ D.①④③②
难度: 中等查看答案及解析
-
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是
A.根据纯净物的元素组成,将纯净物分为单质和化合物
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类
难度: 中等查看答案及解析
-
将少量Na2O2固体加入到Ca(HCO3)2溶液中,下列有关说法正确的是
A.溶液中只有气体产生
B.溶液中只有沉淀产生
C.溶液中可能有反应Ca2++OH-+HCO-3=CaCO3↓+H2O发生
D.溶液中产生的气体是二氧化碳。
难度: 中等查看答案及解析
-
下列物质转化在给定条件下能实现的是
①
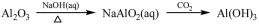
②
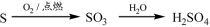
③
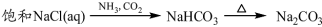
④
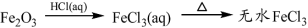
⑤
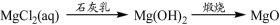
A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结 论
A
用铂丝蘸取溶液进行焰色反应
火焰呈黄色
溶液中无K+
B
向溶液中先滴加稀盐酸,再滴加BaCl2溶液
先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀
溶液中一定含有SO42-
C
向一定浓度的CuSO4溶液中通入适量H2S气体
出现黑色沉淀
H2S的酸性比H2SO4强
D
向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
难度: 中等查看答案及解析
-
下列各组离子在指定的溶液中能
大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32- 、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.①②⑤ B.③⑤⑥ C.②④ D.②④⑥
难度: 困难查看答案及解析
-
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42- 和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-
D.取少量硫酸亚铁铵晶体放入试管,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有NH4+
难度: 中等查看答案及解析
-
将足量CO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、SiO32-、Cl-、NO3- B.H+、NH4+、Al3+、SO42-
C.Na+、S2-、OH-、SO42- D.Na+、C6H5O-、CH3COO-、HCO3-
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
①向明矾溶液中加入过量的氢氧化钡溶液:Al3+ + 2SO42-+ 2 Ba2+ + 4OH-= AlO2- + 2BaSO4↓+ 2H2O
②向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+ = Fe2++2H2O
③向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O
④向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
CH2BrCOOH+OH-
CH2BrCOO-+H2O
⑤向含0.5mol溴化亚铁溶液中通入0.5mol氯气2Fe2++Cl2=2Fe3++2Cl-
⑥澄清石灰水中滴加少量碳酸氢钙溶液Ca2++OH-+HCO3-=H2O+CaCO3↓
⑦氯化铝溶液中加入过量的氨水Al3++4NH3•H2O=AlO2-+4NH4++2H2O
⑧小苏打与甲酸溶液混合H++CO32-+HCOOH=CO2↑+HCOO-+H2O
A.②④ B.①⑥ C.③⑤⑥ D.①③⑦
难度: 困难查看答案及解析
-
AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,则消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系可用如图来表示,则下列关系图正确的是
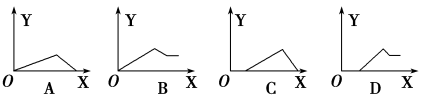
难度: 中等查看答案及解析
-
将ag Fe2O3、Al2O3样品溶解在过量的200 mL 0.05 mol/L的硫酸溶液中然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.4 mol·L-1 D.0.8 mol·L-1
难度: 中等查看答案及解析
-
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2-、Al3+、CO32-、NO3-七种离子中的几种,向该溶液中逐滴加入一定量1 mol·L-1 NaOH溶液的过程中,开始没有沉淀,而后才有沉淀。则下列判断正确的是
A.溶液中可能含有AlO2- B.溶液中可能含有NO3-
C.溶液中一定不含Fe2+和Fe3+ D.溶液中可能含有Fe3+,但一定不含Fe2+
难度: 困难查看答案及解析
-
用1 L 0.5 mol·L-1NaOH溶液吸收0.4 mol CO2,所以溶液中的CO和HCO的物质的量浓度之比约是
A.3∶1 B.1∶2 C.2∶3 D.1∶3
难度: 中等查看答案及解析
-
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是
①用50 mL量筒量取5.2 mL稀硫酸 ②用分液漏斗分离苯和四氯化碳的混合物
③用托盘天平称量11.7g氯化钠晶体 ④用碱式滴定管取23.10 mL溴水
⑤用瓷坩埚灼烧各种钠化合物 ⑥用250 mL容量瓶配制250 mL 0.2 mol/L的NaOH溶液
A.①②④ B.③⑥ C.②③④⑥ D.③⑤⑥
难度: 中等查看答案及解析
-
关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
C.加入Ba(NO3)2,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在
难度: 中等查看答案及解析
-
今有一混合物的水溶液,可能大量含有以下离子中的若干种:K+、NH4+、Cl—、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下针对原溶液的推测正确的是
A.Cl—一定不存在 B.K+一定存在 C.Mg2+一定存在 D.Ba2+可能存在
难度: 中等查看答案及解析
-
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述正确的是
A.还原剂与氧化剂的物质的量之比为1:8
B.该过程说明Fe(NO3)2 溶液可加酸酸化
C.若有1mol NO3- 发生氧化反应,则转移8mol电子
D.若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+
难度: 中等查看答案及解析
-
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
A.镁铝合金与盐酸反应转移电子总数为0.1NA
B.x=2y
C.沉淀是Mg(OH)2和Al(OH)3的混合物
D.2x=y
难度: 中等查看答案及解析
-
某固体物质A在一定条件下受热分解产物都是气体,有关的化学方程式为:2A=B↑+2C↑+2D↑。若生成的混合气体对氘气的相对密度为d,则A的相对分子质量为
A.2d B.2.5d C.5d D.10d
难度: 中等查看答案及解析
-
在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2,有一半Br-变为Br2(已知Br2 能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
A.0.16mol/L B.0.02mol/L C.0.20mol/L D.0.25mol/L
难度: 中等查看答案及解析
-
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
① ω=
② c=
③ 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④ 上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A.①④ B.②③ C.①③ D.②④
难度: 中等查看答案及解析
-
等物质的量的过氧化钠与碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.NaOH Na 2 CO 3 B.Na 2 CO 3
C.Na 2 O 2 Na 2 CO 3 D.NaHCO 3 Na 2 CO 3
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值。下列说法正确的是
A.18gD2O和18gH2O中含有的质子数均为10NA
B.2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
难度: 中等查看答案及解析
-
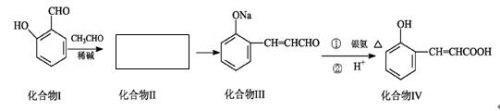
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为
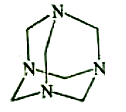
A.1:1 B.2:3 C.3:2 D.2:1
难度: 中等查看答案及解析
-
已知某有机物C6H12O2酸性条件下能发生水解反应生成A和B,B能氧化成C。若A、C都能发生银镜反应,则C6H12O2符合条件的结构简式有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G→Q+NaCl ②Q+H2O
X+H2
③Y+NaOH-→G+Q+H2O ④Z+NaOH-→Q+X+H2O
这五种化合物中Cl元素化合价由高到低的顺序是
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
难度: 中等查看答案及解析
-
向一盛有22.4L(标准状况下)CO2和CO混合气体的密闭容器中投入1molNa2O2固体,用间断的电火花引发至充分反应,下列对反应完全后容器里剩余固体的叙述正确的是
A.1mol Na2CO3
B.0.5 mol Na2CO3,0.5mol Na2O2
C.0.25 mol Na2CO3,0.75 mol Na2O2
D.0.75 mol Na2CO3,0.25 mol Na2O2
难度: 中等查看答案及解析