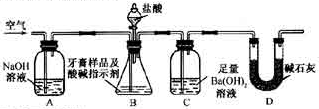
-
I.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 10C+P4O10==P4+10CO
每生成 1molP4 时,就有________mol电子发生转移。
(3)硫代硫酸钠(Na2S2O2)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素 完全氧化,剩余的I2 用Na2S2O2溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入amolL-1I2溶液V1ml,充分反应后,用Na2S2O2溶液滴定剩余的I2,消耗bmolL-1 Na2S2O2溶液V2ml.该溶液中维生素C的物质量是________mol。
(4)在酸性溶液中,碘酸钠(KIO3)和亚硫酸钠可发生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
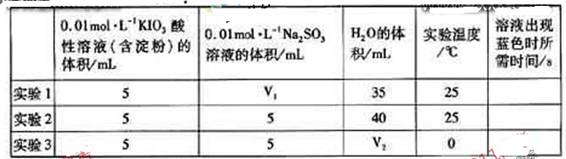
该实验的目的是______;表中 ______ML。
______ML。
II 稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)钵(Ce)是地壳中含量最高的稀土元素,在加热条件下CeCl3易发生水解,无水CeCl3,可用加热CeCl3• 6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是___________。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH ≈3. Ce5+通过下列反应形成Ce
(OH)4沉淀得以分离。完成反应的离子方程式:
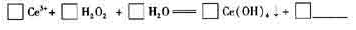
-
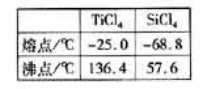
四氧化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成为是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
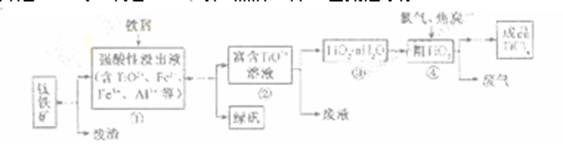
回答下列问题
( 1 ) 往①中缴入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:

加入铁屑的作用是 。
(2)在② ③工艺过程中需要控制条件以形成
③工艺过程中需要控制条件以形成 溶液,该溶液的分散质颗粒直径大大小在________ 范围。
溶液,该溶液的分散质颗粒直径大大小在________ 范围。
(3)若把③中制得得固体 用酸清洗除去其中的
用酸清洗除去其中的 杂质,还可以制得钛白粉。已知25°C时,
杂质,还可以制得钛白粉。已知25°C时,  该温度下反应
该温度下反应 的平衡常数K= ________。
的平衡常数K= ________。
(4)已知:

写出④中 和焦炭、氧气反应生成也太
和焦炭、氧气反应生成也太 气体的热化学方程式:
气体的热化学方程式:
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是________(只要求写出一项 )。
(6)依据右表信息,要精制含少量 杂质的
杂质的 的,
的,
可采用________方法。
-
氮元素可以形成多种化合物。
回答以下问题:
(1)基态氮原子的价电子排布式是__________________。
(2)C、N、O三种元素第一电离能从大到小的顺许昌是_________________。
(3)肼(N2H4)分子可视为NH3 分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①NH3 分子的空间构型是____________;N2H4分子中氮原子轨道的杂化类型是____________________。
②肼可用作火箭燃料,燃烧时发生的反应是:


若该反应中有4mol N—H键断裂,则形成的 键有___________mol。
键有___________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体得4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物是别的是________________(填标号)。

a.CF4 b. CH4 c. NH4+ d.H2O
-
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:

填写下列空白:
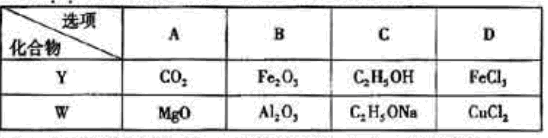
(1)甲中不含氧原子的官能团是____________;下列试剂能与甲反应而褪色的是s___________(填标号)
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A-D均为有机物):
 A的分子式是___________,试剂X可以是___________。
A的分子式是___________,试剂X可以是___________。



利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 ________ 。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110.丁与FeCl3溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为 ________。
L-1醋酸溶液的Ph=a ,下列能使溶液pH=(a+1)的措施是
L-1盐酸 D.提高溶液的温度
),发生反应:
,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是

固体后,c(Sn2)变小

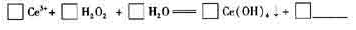






 A的分子式是___________,试剂X可以是___________。
A的分子式是___________,试剂X可以是___________。