-
下列说法正确的是
A.分子中一定存在化学键
B.分子中若有化学键,则一定存在σ键
C.p和p轨道不能形成σ键
D.含π键的物质不如含σ键的物质稳定
难度: 简单查看答案及解析
-
据报道,1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤—239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是
A.第3周期第ⅠA族 B.第4周期第ⅠA族
C.第5周期第ⅠA族 D.第3周期第ⅡA族
难度: 简单查看答案及解析
-
下列各组指定的元素,不能形成AB2型化合物的是
A.2s22p2 和2s22p4 B.3s23p4 和2s22p4
C.3s2 和2s22p5 D.3s1和3s23p4
难度: 简单查看答案及解析
-
基态原子的4s能级中只有1个电子的元素共有
A.1种 B.2种 C.3种 D.8种
难度: 简单查看答案及解析
-
在乙烯分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
难度: 简单查看答案及解析
-
下列分子中所有原子的价电子层都满足最外层8电子结构的是( )
A.六氟化氙(XeF6) B.次氯酸(HClO)
C.二氯化硫(S2Cl2) D.三氟化硼(BF3)
难度: 简单查看答案及解析
-
已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是
A.H2SeO3 B.HMnO4 C.H3BO3 D.H3PO4
难度: 简单查看答案及解析
-
下列事实,不能用氢键知识解释的是
A. 水和乙醇可以完全互溶
B. 溴化氢比碘化氢稳定
C. 水的熔点比干冰的熔点高
D. 液态氟化氢的化学式有时可以写成(HF)n的形式
难度: 简单查看答案及解析
-
下列各组中的两种固态物质熔化(或升华)时,克服的微粒间相互作用力属于同种类型的是
A 碘和碘化钠 B 金刚石和重晶石(BaSO4)
C 干冰和二氧化硅 D 冰醋酸和硬脂酸甘油酯
难度: 简单查看答案及解析
-
下列微粒不能形成配位键的是
A.Cu2+ B.NH3
C.H+ D.NH
难度: 简单查看答案及解析
-
下表所列物质晶体的类型全部正确的一组是
原子晶体
离子晶体
分子晶体
A.
氮化硅
磷酸
单质硫
B.
单晶硅
烧碱
白磷
C.
金刚石
硅铁
冰
D.
铁
尿素
冰醋酸
难度: 简单查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.元素W和M的某些单质可作为水处理中的消毒剂
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.X、M两种元素只能形成X2M型化合物
难度: 简单查看答案及解析
-
已知信息:[Cu(NH3)4]SO4的电离方程式:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。具有6个配体的Co3+的配合物CoClm·nNH3,若1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,则m,n的值分别是
A.m=1,n=5 B.m=3,n=3 C.m=5,n=1 D.m=3,n=4
难度: 简单查看答案及解析
-
钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的结构示意图为下图,它的化学式是
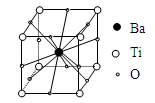
A.BaTi8O12 B.BaTi4O6
C. BaTi2O4 D.BaTiO3
难度: 简单查看答案及解析
-
下列说法正确的是(NA为阿伏加德罗常数)
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为3NA
C.12 g金刚石中含有C—C键的个数为2NA
D.60gSiO2中含Si—O键的个数为2NA
难度: 简单查看答案及解析
-
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
难度: 简单查看答案及解析
-
下列有关物质性质、结构的表述均正确,且存在因果关系的是
表述Ⅰ
表述Ⅱ
A
在水中,NaCl的溶解度比I2的溶解度大
NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力
B
通常条件下,CH4分子比PbH4分子稳定性高
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小
C
在形成化合物时,同一主族元素的化合价相同
同一主族元素原子的最外层电子数相同
D
P4O10、C6H12O6溶于水后均不导电
P4O10、C6H12O6均属于共价化合物
难度: 简单查看答案及解析
-
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如下图所示,有关说法正确的是

A.该晶体为分子晶体
B.晶体的化学式为Ba2O2
C.该氧化物的电子式为
D.与每个Ba2+距离相等且最近的Ba2+共有6个
难度: 简单查看答案及解析
-
已知氯化钠的摩尔质量是58.5g/mol,密度是2.2g/ cm 3,则氯化钠晶体中相邻的钠离子核间距离的数值最接近于
A 4.0×10-8cm B 3.5×10-8cm
C 3.0×10-8cm D 5.0×10-8cm
难度: 简单查看答案及解析
