-
Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是
A. 负极反应式为Mg-2e-=Mg2+
B. 正极反应式为Ag++e-=Ag
C. 电池放电时Cl-由正极向负极迁移
D. 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
难度: 简单查看答案及解析
-
下列方程式书写错误的是( )
A. NaHCO3水解的离子方程式:
+ H2O
+H3O+
B. NH4Cl水解的化学方程式:NH4Cl+H2O
NH3·H2O+HCl
C. Al(OH)3的两性电离方程式:H++AlO2−+H2O
Al(OH)3
Al3++3OH−
D. NaHSO3的电离方程式:NaHSO3
Na++
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 石油、沼气、天然气、植物油都属于可再生能源
B. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
C. 水蒸气变为液态水时放出的能量就是该变化的反应热
D. 同温同压下,H2(g)+Cl2(g)
2HCl(g)在光照和点燃条件下的ΔH不同
难度: 简单查看答案及解析
-
在一定条件下,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是( )
A. 反应开始时,正反应速率最大,逆反应速率为零
B. 随着反应的进行,正反应速率逐渐减小,最后为零
C. 随着反应的进行,逆反应速率逐渐增大,最后不变
D. 随着反应的进行,正反应速率逐渐减小,最后不变
难度: 中等查看答案及解析
-
在密闭容器中发生反应:C(s)+CO2(g)
2CO(g),下列说法不正确的是( )
A. 增大CO2浓度可以加快反应速率
B. 升高温度可以加快反应速率
C. 容器体积不变时,向其中充入N2,反应速率不变
D. 增加碳的质量可以加快反应速率
难度: 中等查看答案及解析
-
下列关于反应热和热化学方程式的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO2(g) =2CO(g)+O2(g)的ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则分解水的热化学方程式为2H2O(l) =2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
D. 1 mol甲烷完全燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:
① CH4(g)+H2O(g)
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
② 2CH4(g)+O2(g)
2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是( )
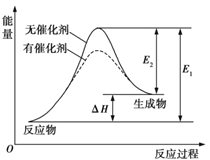
A. E1表示2CH4(g)+O2(g)
2CO(g)+4H2(g)的活化能
B. E2表示CH4(g)+H2O(g)
CO(g)+3H2(g)的活化能
C. 该图示为反应②的反应过程与能量变化示意图
D. 一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
难度: 中等查看答案及解析
-
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是( )
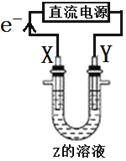
A. 氯碱工业中,若X、Y均为石墨,Y附近能得到氯气
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C. 外加电流的阴极保护法中,Y是待保护金属
D. 电镀工业中,X是待镀金属,Y是镀层金属
难度: 中等查看答案及解析
-
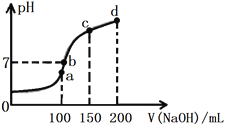
某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关数据如下表:
滴定次数
待测氢氧化钠溶液的体积/mL
0.100 0 mol·L-1盐酸的体积/mL
滴定前刻度
滴定后刻度
第一次
25.00
0.00
27.45
第二次
25.00
0.00
30.30
第三次
25.00
0.00
27.55
下列说法正确的是:
A. 当溶液从无色刚好变成红色时,则滴定终点达到
B. 该氢氧化钠溶液中c(NaOH)=0.110 0 mol·L-1
C. .滴定达终点时,滴定管尖嘴有悬液,则测定结果偏低
D. 实验中锥形瓶应用待测氢氧化钠溶液润洗
难度: 中等查看答案及解析
-
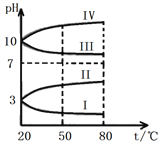
已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。对于浓度均为0.1 mol·L−1的NaHSO3溶液和NaHCO3溶液,溶液中各微粒的物质的量浓度关系正确的是(R表示S或C) ( )
A. 两溶液中均有c(Na+) > c(
) > c(H+) > c(
) > c(OH−)
B. 两溶液中均有c(Na+) + c(H+) = c(
) + c(
) + c(OH−)
C. 两溶液中均有c(H+) + c(H2RO3) = c(
) + c(OH−)
D. 两溶液中c(Na+)、c(
)、c(
)分别对应相等
难度: 困难查看答案及解析
-
已知:A(g) + 2B(g)
2C(g) ΔH= −Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
A. 平衡前,随着反应进行,容器内气体密度逐渐减小
B. 平衡时,该反应放出的热量为Q kJ
C. 平衡后,再向容器中通入1 mol氦气,A的转化率增大
D. 平衡后,缩小容器容积达到新平衡,A的浓度增大
难度: 中等查看答案及解析
-
工业上冶炼钛的有关反应如下所示:
① C(s) + O2(g)
CO2(g) ΔH1
② 2CO(g) + O2(g)
2CO2(g) ΔH2
③ TiO2(s) + 2Cl2(g)
TiCl4(g) + O2(g) ΔH3
④ TiCl4(s) + 2Mg(s)
2MgCl2(s) + Ti(s) ΔH4
⑤ TiO2(s) + 2Cl2(g) + 2C(s)
TiCl4(g) + 2CO(g) ΔH5
下列有关推断正确的是( )
A. 2ΔH1=ΔH2 B. ΔH1<0,ΔH2>0
C. ΔH5=ΔH3+2ΔH1-ΔH2 D. 2ΔH1-ΔH2>0
难度: 困难查看答案及解析
-
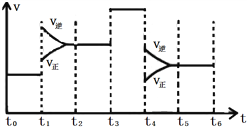
下列各表述正确的是( )
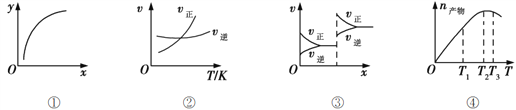
A. 图①表示在恒容容器中MgSO4(s) + CO(g)
MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
B. 图②表示其他条件一定时,反应A(g)+3B(g)
2C(g)的反应速率随温度变化的图像,正反应ΔH>0
C. 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况
D. 恒压密闭容器中加入一定量A、B,发生反应A(g)+3B(g)
2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
难度: 困难查看答案及解析
-
已知2SO2(g) + O2(g)
2SO3(g) ΔH= −197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p:p甲=p丙>2p乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
难度: 困难查看答案及解析
-
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp = cm(An+)·cn(Bm−),称为难溶电解质的溶度积。已知下表数据:
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
Ksp(25°C)
8.0×10−16
2.2×10−20
4.0×10−38
完全沉淀时的pH范围
≥9.6
≥6.4
3~4
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
A. 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B. 该溶液中c(SO42−)∶[c(Cu2+)+c(Fe2+)+ c(Fe3+)]>5∶4
C. 向该溶液中加入适量氯水,并调节pH到3〜4后过滤,可获得纯净的CuSO4溶液
D. 在pH=5的溶液中Fe3+不能大量存在
难度: 困难查看答案及解析
-
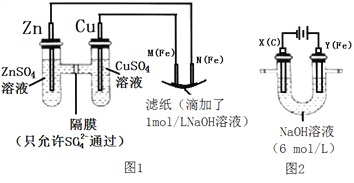
如图所示装置中,a、b、c、d、e、f均为惰性电极,电解质溶液均足量。接通电源后,d极附近显红色。下列说法正确的是( )
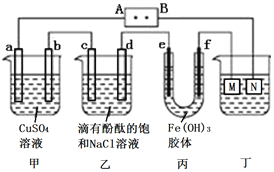
A. 电源B端是正极
B. a、c电极均有单质生成,它们的物质的量之比为2∶1
C. 欲用丁装置给铜镀银,N应为Ag,电解质溶液为 AgNO3溶液
D. f极附近变红,说明氢氧化铁胶粒带正电荷
难度: 中等查看答案及解析
-
在373 K时,把0.5 mol N2O4通入体积为5 L的恒容真空密闭容器中,立即出现红棕色气体。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系达到平衡状态,此时容器内的压强为开始时的1.6倍。下列说法错误的是( )
A. 前2 s以N2O4的浓度变化表示的平均反应速率为0.005 mol·L-1·s-1
B. 在2 s时体系内的压强为开始时的1.1倍
C. 平衡时体系内含N2O4 0.2 mol
D. 平衡时,N2O4的转化率为40%
难度: 困难查看答案及解析
-
现在大量盆栽鲜花都施用了S诱抗素制剂,以保持鲜花盛开。S诱抗素的分子结构如图,下列关于该分子说法正确的是( )
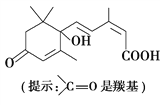
A. 含有碳碳双键、羟基、羰基、羧基 B. 含有苯环、羟基、羰基、羧基
C. 含有羟基、羰基、羧基、酯基 D. 含有碳碳双键、苯环、羟基、羰基
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 按系统命名法,化合物
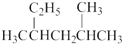 的名称为2﹣甲基﹣4﹣乙基戊烷
的名称为2﹣甲基﹣4﹣乙基戊烷B. 等质量的甲烷、乙烯、1,3﹣丁二烯分别充分燃烧,所消耗氧气的量依次减少
C. 苯酚、水杨酸
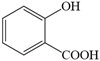 和苯甲酸都是同系物
和苯甲酸都是同系物D. 三硝基甲苯的分子式为C7H3N3O6
难度: 中等查看答案及解析
-
某烃对氢气的相对密度为15,该烃的氯代物最多有
A. 5种 B. 7种 C. 9种 D. 11种
难度: 困难查看答案及解析
-
某烯烃与氢气加成后得到2,2﹣二甲基丁烷,则该烯烃的名称是( )
A. 3,3﹣二甲基﹣1﹣丁烯
B. 3,3﹣二甲基﹣2﹣丁烯
C. 2,2﹣二甲基﹣1﹣丁烯
D. 2,2﹣二甲基﹣3﹣丁烯
难度: 简单查看答案及解析
 2H2↑+O2↑
2H2↑+O2↑