-
下列有关热化学方程式的叙述正确的是
A. 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2
B. 已知甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol
C. 已知中和热为△H=﹣57.3 kJ/mol,则含0.5molH2SO4稀硫酸和足量稀Ba(OH)2溶液反应的放出57.3kJ的热量
D. 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
难度: 简单查看答案及解析
-
下列有关叙述正确的是
A. 淀粉、油脂、杜仲胶和纤维素都由碳、氢、氧元素组成,都是天然高分子化合物
B. 糖类、油脂和蛋白质都能发生水解
C. 蛋白质是人类必需的营养物质,在人体内最终水解成葡萄糖
D. 聚乳酸在微生物作用下可降解成小分子,对环境有利
难度: 简单查看答案及解析
-
下列图示关系中不正确的是( )
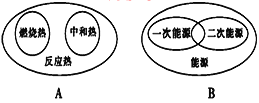
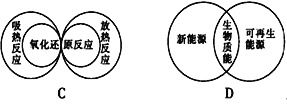
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
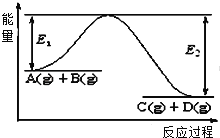
向Na2CO3溶液中滴加盐酸,反应过程中能量变化如右图所示,下列说法正确的是
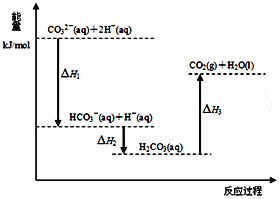
A. 反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)为放热反应
B. ∆H1>∆H2 ∆H2<∆H3
C. CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) ∆H=(∆H1+∆H2+∆H3)
D. H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则∆H3变小
难度: 中等查看答案及解析
-
2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)
2C(g)+zD(g),2s末A的转化率为50%,测得v(D)=0.25mol•L﹣1•s﹣1,下列推断不正确的是
A. 2s末,B的浓度为0.5mol/L B. 2s末,容器内的压强是初始的7/8倍
C. 2s时C的体积分数为2/7 D. z=2
难度: 中等查看答案及解析
-
—定条件下,对于可逆反应X (g)+4Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分別为0.lmol/L、0.4mol/L、0.1mol/L,则下列判断正确的是( )
A. c1:c2=4:1
B. 平衡时,Y和Z的生成速率之比为1: 2
C. c1的取值范围为0mol/L<c1<0.14mol/L
D. 若反应正向进行,X、Y的转化率相等
难度: 困难查看答案及解析
-
在一定温度下的定容容器中,当下列哪些项不再发生变化时,表明反应A(g)+2B(g)
C(g)+D(g)已达到平衡状态①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度④混合气体的总物质的量 ⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积
A. ①②③④⑤⑥⑦⑧ B. ①②③④⑤⑦
C. ①③④⑤ D. ①③④⑤⑧
难度: 中等查看答案及解析

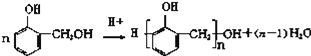
 也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为___________________________________;写出有机物Ⅱ与足量NaHCO3反应的化学方程式________________________________。
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为___________________________________;写出有机物Ⅱ与足量NaHCO3反应的化学方程式________________________________。