-
下列事实或现象与浓硫酸体现出的性质不相符的是
A. 往盛有少量胆矾的表面皿中加浓硫酸,搅拌,固体变白,体现了浓硫酸的吸水性
B. 工业上使用铁槽车运输浓硫酸,体现了浓硫酸的强氧化性
C. 浓硫酸与木炭在加热条件下反应,体现了浓硫酸的强氧化性和酸性
D. 用玻璃棒蘸取浓硫酸滴在白纸上,白纸变黑,体现了浓硫酸的脱水性
难度: 中等查看答案及解析
-
浙江籍科学家屠呦呦因发现青蒿素(C15H22O5)而获得诺贝尔生理学或医学奖。根据物质的分类,青蒿素属于
A. 碱性氧化物 B. 有机物 C. 含氧酸盐 D. 酸性氧化物
难度: 简单查看答案及解析
-
35Cl和 35Cl- 两种微粒中,不同的是
A. 核内质子数 B. 核外电子层数 C. 核内中子数 D. 核外电子数
难度: 简单查看答案及解析
-
下列玻璃仪器中,可以用酒精灯直接加热的是
A.
B.
C.
 D.
D. 难度: 简单查看答案及解析
-
在下列反应中,HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl(浓)
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,11.2L氧气所含的氧原子数为NA
B.2.4g镁变成Mg2+ 时失去的电子数为0.2NA
C.1mol•L-1的CaCl2溶液中含有的Cl- 数为2NA
D.标准状况下,2g氢气所含氢原子数为NA
难度: 中等查看答案及解析
-
下列物质在空气中久置会发生变质,且在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是
A.氢氧化钠固体 B.氯化钠固体 C.金属钠 D.生石灰
难度: 简单查看答案及解析
-
化学药品有特定的保存方式,下列叙述不正确的是
A. 钠保存在细口瓶中并加煤油液封
B. 新制氯水保存在棕色瓶中并置于冷暗处
C. NaOH溶液保存在无色试剂瓶中并要塞紧橡胶塞
D. 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.氧化钠与水反应:O2-+2H2O=2OH-
B.氯气通入溴化钠溶液中:Cl2+2Br-=2Cl-+Br2
C.硫酸铜溶液与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓
D.氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
难度: 中等查看答案及解析
-
关于Na2CO3和NaHCO3性质的说法正确的是
A.热稳定性:Na2CO3 < NaHCO3
B.相同温度时的水溶性:Na2CO3 < NaHCO3
C.等物质的量浓度的溶液的碱性:Na2CO3 < NaHCO3
D.与同浓度的盐酸反应的剧烈程度:Na2CO3 < NaHCO3
难度: 中等查看答案及解析
-
《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”、“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2O6)。下列关于硅酸铜钡的说法不正确的是
A. 是一种硅酸盐 B. 性质稳定,不易脱色
C. 易溶于强酸和强碱 D. 可用氧化物形式表示为BaO•CuO•2SiO2
难度: 中等查看答案及解析
-
下列有关工业生产的说法错误的是
A.高炉炼铁、生产普通硅酸盐水泥和普通玻璃都要用到的原料是石灰石
B.用电解饱和食盐水的方法制备金属钠
C.通常用海水提取食盐后的母液为原料制取溴单质
D.利用焦炭在高温下还原二氧化硅可制备粗硅
难度: 中等查看答案及解析
-
下列各组离子,在强酸性溶液中能大量共存的是
A.Na+、K+、Ca2+、HCO3- B.NO3-、Cl-、Na+、Ag+
C.Cu2+、Fe2+、SO42-、Cl- D.Mg2+、Na+、Cl-、CH3COO-
难度: 中等查看答案及解析
-
为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
选项
物质
试剂
分离方法
A
Cl2(水蒸气)
生石灰
洗气
B
KCl溶液(K2SO4)
适量Ba(NO3)2溶液
过滤[
C
NaCl固体(KNO3)
蒸馏水
冷却结晶
D
花生油(水)
————
分液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
“类推”是学习化学的一种好方法。但是有些“类推”也会由于物质的特性等原因产生错误。下列几种类推结论中正确的是
A.金属镁能在CO2中燃烧,则金属钠也能在CO2中燃烧
B.金属钠与水反应产生NaOH和H2,则金属铜与水反应也能产生Cu(OH)2和H2
C.Cl2+H2O
HCl+HClO是氧化还原反应,则ICl+H2O
HCl+HIO也是氧化还原反应
D.CO2与H2O反应生成H2CO3,则SiO2与H2O反应也可以生成H2SiO3
难度: 中等查看答案及解析
-
某同学想用实验证明硫酸铜溶液显蓝色与SO42-无关,则下列实验无意义的是
A.观察硫酸钠溶液没有颜色
B.加水稀释硫酸铜溶液,溶液蓝色变浅
C.向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未消失
D.向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色消失
难度: 中等查看答案及解析
-
下列关于物质或离子检验的叙述正确的是
A. 向某溶液中加入BaCl2溶液,出现白色沉淀,再加稀硝酸溶液,若沉淀不溶解,则该溶液中肯定有SO42-
B. 灼烧某白色粉末,火焰呈黄色,则证明原粉末中肯定有Na+,无K+
C. 向某溶液中滴加AgNO3溶液后,出现白色沉淀,再加稀盐酸,若沉淀不溶解,则证明溶液中肯定有Cl-
D. 在某盐溶液中加入氢氧化钠浓溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则该溶液中肯定有NH4+
难度: 中等查看答案及解析
-
如右图是研究二氧化硫性质的微型实验装置(实验时用另一表面皿扣在上面)。现用75%硫酸溶液和亚硫酸钠晶体反应制取SO2气体并进行实验,实验现象很明显。下列说法中错误的是
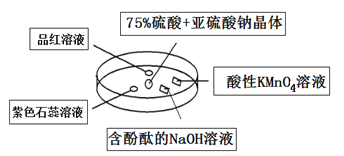
A.品红溶液褪色
B.紫色石蕊溶液先变红后褪色
C.酸性KMnO4溶液紫色褪去
D.含酚酞的NaOH溶液红色变浅
难度: 困难查看答案及解析
-
下图为从海带中提取碘的工业生产过程,有关说法错误的是

A.因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素
B.碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀
C.在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等
D.在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗
难度: 困难查看答案及解析
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制ClO2: 2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是:
A.KClO3在反应中失去电子 B.H2SO4是还原剂
C.1 mol KClO3参加反应有2mol电子转移 D.H2C2O4在反应中被氧化
难度: 中等查看答案及解析
-
向含l mol HCl和l mol MgSO4的混合溶液中加入1 mol•L-1Ba(OH)2溶液,产生沉淀的 物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是

A. A B. B C. C D. D
难度: 困难查看答案及解析
-
某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和 Na+。某同学为确定其组分,设计并完成了如下实验:
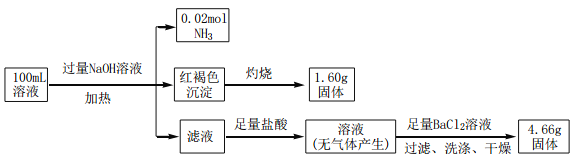
由此可推测原溶液中:
A. SO42-、NH4+和Na+ 一定存在,CO32-一定不存在
B. SO42-、NH4+一定存在,Na+ 和CO32-一定不存在
C. c(Fe3+)=0.1 mol•L-1
D. c(Cl-)≥0.4mol•L-1
难度: 困难查看答案及解析