-
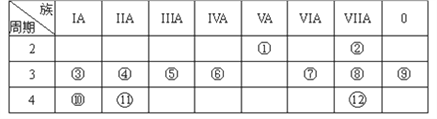
下列关于20Ne和22Ne的说法正确的是( )
A. 20Ne和22Ne互为同位素 B. 20Ne和22Ne属于同一种核素
C. 20Ne和22Ne的中子数相同 D. 20Ne和22Ne的质量数相同
难度: 简单查看答案及解析
-
19世纪中叶,门捷列夫的突出贡献是
A. 提出原子学说 B. 提出分子学说
C. 发现元素周期律 D. 提出电离学说
难度: 简单查看答案及解析
-
可逆反应达到化学平衡状态的重要特征是 ( )
A. 反应停止了 B. 正、逆反应的速率都为0
C. 正、逆反应都还在进行 D. 正、逆反应的速率相等且不为0
难度: 简单查看答案及解析
-
在铜锌原电池中,锌电极上发生的反应为Zn-2e-=Zn2+,则( )
A. 锌电极为负极 B. 锌电极为正极
C. 电子从铜电极流向锌电极 D. 反应中Zn被还原
难度: 简单查看答案及解析
-
下列图示变化为吸热反应的是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. 氯化钠的分子式:NaCl
B. 硫原子的结构示意图 :
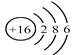
C. 过氧化钠的电子式:

D. 中子数为10的氧原子:108O
难度: 简单查看答案及解析
-
以下反应属于吸热反应的是( )
A. 锌与稀硫酸的反应 B. 氯化铵与氢氧化钡晶体反应
C. 双氧水的分解反应 D. 氢氧化钠与盐酸的反应
难度: 中等查看答案及解析
-
下列物质中,既含有离子键又含有共价键的化合物是
A. CaCl2 B. Na2O2 C. K2O D. C2H5OH
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
A. 原子半径:Cl>S>P B. 还原性:Na>Mg>Al
C. 稳定性:HF>HCl>HBr D. 酸性:HClO4>H2SO4>H3PO4
难度: 中等查看答案及解析
-
下列装置中属于原电池的是 ( )
A.
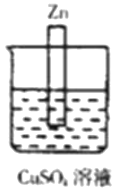 B.
B.  C.
C. 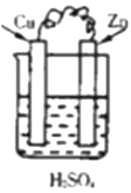 D.
D. 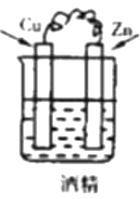
难度: 中等查看答案及解析
-
在铁与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,若不考虑反应过程中溶液体积的变化,则10s内消耗硫酸平均反应速率是( )
A. 0.6mol/(L•s)-1 B. 1.8mol/(L•s)-1
C. 0.06 mol/(L•s)-1 D. 0.18 mol/(L•s)-1
难度: 中等查看答案及解析
-
下列变化中与原电池反应的有关的是
A. 金属铁、铝在冷的浓硫酸中钝化
B. 在空气中金属铝表面迅速被氧化形成保护膜
C. 红热的铁丝与水接触表面形成蓝色保护层
D. 在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生
难度: 简单查看答案及解析
-
化学平衡主要研究下列哪一类反应的规律( )
A. 可逆反应 B. 任何反应 C. 溶液间反应 D. 气体间反应
难度: 简单查看答案及解析
-
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
A. 浓硫酸与水 B. 生石灰与水 C. 熟石灰与水 D. 氯化钠与水
难度: 中等查看答案及解析
-
下列物质在一定条件下,可与CH4发生反应的是
A. 氯气 B. 溴水 C. 氢氧化钠溶液 D. 酸性KMnO4溶液
难度: 简单查看答案及解析
-
下列反应属于取代反应的是( )
A. CH4+2O2
CO2+2H2O
B. NaOH+HCl===NaCl+H2O
C. CH2=CH2+H2
CH3—CH3
D. CH4+Cl2
CH3Cl+HCl
难度: 简单查看答案及解析
-
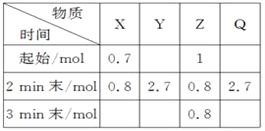
图是可逆反应X2+ 3Y2
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是

A. t1时,只有正方向反应
B. t2时,反应未到达限度
C. t2- t3,反应不再发生
D. t2- t3,各物质的浓度不再发生变化
难度: 中等查看答案及解析