-
PM2. 5是指大气中直径小于或等于2.5微米的颗粒物,严重危害人体健康,也称为可入肺颗粒物。近年来我国PM2.5污染问题日益凸显。2013年长沙市开展PM2.5和臭氧监测,每天都公布空气质量级别。下面所列各项,在空气质量日报中完全正确的是( )
①可吸入颗粒物 ②总悬浮颗粒物 ③氢氧化物 ④二氧化碳 ⑤二氧化硫
⑥二氧化氮 ⑦一氧化碳 ⑧一氧化氮 ⑨氮气 ⑩臭氧
A.①③⑤⑦⑨ B.②③⑤⑥⑦ C.②④⑥⑦⑩ D.①⑤⑥⑦⑩
难度: 中等查看答案及解析
-
下列化学用语中,书写错误的是( )
A.硫离子的结构示意图:
B.氟化钠的电子式:
C.甲基的电子式:
D.次氯酸的结构式:H―O―Cl
难度: 中等查看答案及解析
-
设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
A.1 mol Cl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为1.5nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
难度: 中等查看答案及解析
-
在无色透明的酸性溶液中,能较大量共存的离子组是( )
A. MnO4-、K+、SO42-、Na+ B.Na+、SiO32-、K+、NO3-
C.NH4+、NO3-、Al3+、Cl- D.K+、SO42-、HCO3-、Na+
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向盐酸中滴加氨水:H++OH-=H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
难度: 中等查看答案及解析
-
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则( )
A.原子半径:丙<丁<乙
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.1.0mol/LNH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
难度: 中等查看答案及解析
-
已知反应: ①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
②H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol 下列结论正确的是( )
A.碳的燃烧热大于110.5kJ/mol
B.反应①放出的热量为221kJ
C.稀硫酸与稀氨水溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
难度: 中等查看答案及解析
-
下列物质不能使红墨水褪色的是( )
A.活性炭 B.过氧化钠 C.NaCl溶液 D.漂白粉
难度: 简单查看答案及解析
-
将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是( )
A.一定有甲烷 B.一定有乙烯 C.一定没有甲烷 D.一定有乙烷
难度: 简单查看答案及解析
-
下列叙述中一定能判断某化学平衡发生移动的是( )
A.混合物中各组分的浓度改变 B.正、逆反应速率改变
C.混合物中各组分的含量改变 D.混合体系的压强发生改变
难度: 中等查看答案及解析
-
天然存在的金属钫(Fr)极微量。它的21种已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是( )
A.在空气中燃烧时生成氧化物Fr2O B.在已知元素中具有最大的原子半径
C.氧化物对应的水化物碱性极强 D.其单质的熔点比金属钠的熔点低
难度: 简单查看答案及解析
-
有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
A.三种溶液pH的大小顺序是③>②>①
B.若将三种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL 0.1mol/L盐酸后,pH最大的是①
D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
难度: 困难查看答案及解析
-
在0.1 mol/L的Na2CO3溶液中,下列关系正确的是( )
A.c(Na+)=2c(CO
) B.c(OH-)=2c(H+)
C.c(HCO
)>c(H2CO3) D.c(Na+)<c(CO
)+c(HCO
)
难度: 中等查看答案及解析
-
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是 ( )
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-2b kJ • mol-1
B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l); ΔH=2b kJ • mol-1
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-4b kJ • mol-1
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=b kJ • mol-1
难度: 中等查看答案及解析
-
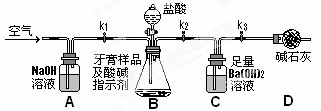
能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶溶液区别的一种试剂是( )
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.NaOH
难度: 中等查看答案及解析
-
人造地球卫星用的一种高能电池——银锌电池,该电池的电极反应式为:
Zn+2OH- -2e- = ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,据此判断氧化银是( )
A.负极,并被氧化 B.正极,并被还原
C.负极,并被还原 D.正极,并被氧化
难度: 中等查看答案及解析
-
在2009年10月1日,新的饮用矿泉水强制性国家标准《饮用天然矿泉水》正式实施,其中“溴酸盐(BrO3-)”这一潜在致癌物质被做了严格限制。有关专家解释,矿泉水在开采过程中会含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是( )
A.该过程中溴化物(Br-)得到电子
B.该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂
C.该过程中溴元素被还原,氧元素被氧化
D.该过程中溴元素发生氧化反应,氧元素发生还原反应
难度: 中等查看答案及解析
-
进行化学实验、观察实验现象,通过分析、推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是( )
A.将N2和过量的O2在高温或放电的条件下反应得到红棕色的气体,说明NO为红棕色气体
B.用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中含Na+
C.在AgNO3的溶液中加入锌粉,能置换出银,说明Ag+的还原性比Zn2+强
D.浓硫酸放入蔗糖中,能使蔗糖炭化,说明浓硫酸具有吸水性
难度: 中等查看答案及解析
-
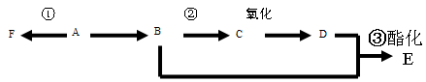
A、B、C、D、E都是中学化学中常见物质,它们均含有同一种短周期元素,在一定条件下可发生如图所示的转化,其中A是单质,B在常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。下列判断中不合理的是( )
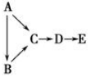
A.A不可能是金属 B.由C生成D肯定发生了电子转移
C.由A生成C肯定属于离子反应 D. B与E可能反应生成盐
难度: 中等查看答案及解析