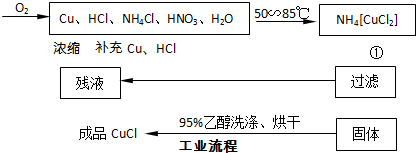
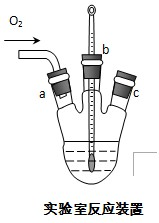
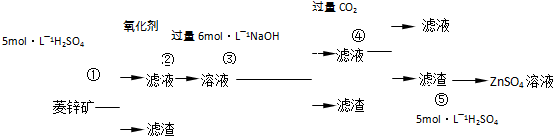
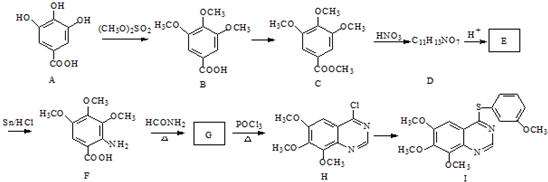
-
用NA表示阿伏伽德罗常数的值.下列叙述正确的组合是( )
①2.3g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA
②含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
③标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA.
④25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
⑤100mL 1mol•L-1 AlCl3溶液中含阳离子数大于0.1NA
⑥含有NA个NO2、N2O4分子的混合气体,降低温度,混合气体的分子总数小于NA.
A.①②⑥
B.②④⑥
C.③⑤⑥
D.①⑤⑥难度: 中等查看答案及解析
-
绿色世博,节能环保是2010年上海世博会的核心目标.下列措施不必要的是( )
A.用新能源汽车承担世博园区内的交通任务
B.用废弃饮料盒等制作供游客休息用的座椅
C.设置雨水收集器,经过滤和处理后,用于花园灌溉和冲洗厕所
D.对园区内空气中二氧化碳含量进行监测,确保举办一个低碳世博会难度: 中等查看答案及解析
-
下列有关化学用语正确的是( )
A.Cl-的结构示意图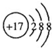
B.次氯酸分子的电子式:
C.CH4Si的结构式:
D.质量数为137的钡原子难度: 中等查看答案及解析
-
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系,下列说法正确的是( )
A.X、Y、Z一定是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.若X、Y都为金属单质,则Z必为非金属单质
D.如果X、Y都为非金属单质,则Z必为金属单质难度: 中等查看答案及解析
-
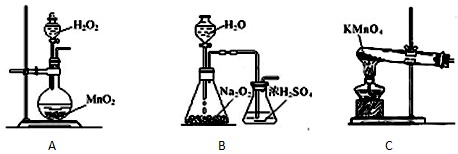
用下列实验装置进行的实验,能达到相应实验目的是( )
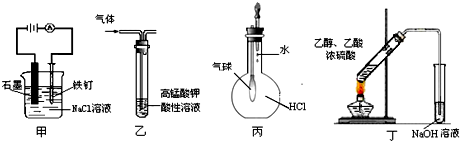
A.装置甲:防止铁钉生锈
B.装置乙:除去乙烯中混有的乙炔
C.装置丙:验证HCl气体在水中的溶解性
D.装置丁:实验室制取乙酸乙酯难度: 中等查看答案及解析
-
如图所示为不饱和烃加氢时的能量变化示意图,具体数据如下:
下列有关说法不正确的是( )反应 △E CH3C≡CCH3+2H2→CH3CH2CH2CH3 278kJ/mol CH2═CH-CH═CH2+2H2→CH3CH2CH2CH3 239kJ/mol 
A.1mol CH3C≡CCH2CH═CHCH═CH2与2molH2反应的主要产物:CH3C≡C(CH2)4CH3
B.CH3CHBrCHBrCH3与NaOH的醇溶液共热后的主要产物(M):CH2═CHCH═CH2
C.CH3CHBrCHBrCH3与NaOH的醇溶液共热后的副产物(N):CH3C≡CCH3
D.
已知消去反应是吸热反应,则CH3CHBrCHBrCH3与NaOH的醇溶液共热生成M、N时能量变化的示意图为: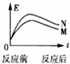
难度: 中等查看答案及解析
-
X、Y、Z和W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y、W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17.则下列有关叙述正确的是( )
A.Y、Z和W三种元素不可能位于同一周期
B.上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高
C.Y和W所形成的含氧酸均为强酸
D.X、Y、Z和W可形成X5YZ4W的离子化合物难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
C.NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D.在浓度均为0.1 mol•L-1Na2CO3、NaHCO3、、NH4Cl溶液中c(H+)分别为c1、c2、c3、c4,则c4>c3>c2>c1
难度: 中等查看答案及解析
-
早在1807年化学家戴维用电解熔融氢氧化钠制得钠 4NaOH(熔)
4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
Fe3O4+2H2↑十4Na↑.下列有关说法正确的是( )
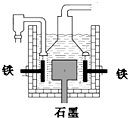
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑
B.盖•吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O
B.Na2S溶液吸收足量SO2:S2-+2SO2+2 H2O═2HSO3-+H2S↑
C.向2 mol•L-1Fe(NO3)2溶液中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O
D.向CuSO4溶液中滴加过量的氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+难度: 中等查看答案及解析
-
利用图所示的有机物X可生产S-诱抗素Y.下列说法正确的是( )
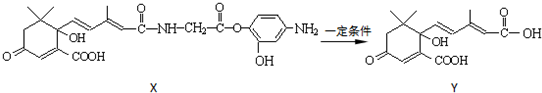
A.X结构中有2个手性碳原子
B.X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐
C.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.1 molX与足量NaOH溶液反应,最多消耗5 mol NaOH,1 molY最多能加成4 molH2难度: 中等查看答案及解析
-
化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
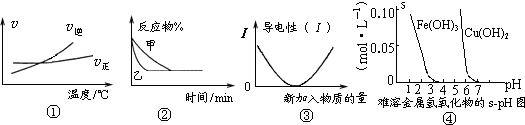
A.根据图①可判断可逆反应“A2(g)+3B2(g)⇌2AB3(g)”的△H>0
B.图②表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右难度: 中等查看答案及解析