-
对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+难度: 中等查看答案及解析
-
某二价金属的碳酸盐和碳酸氢盐的混合物与足量的盐酸反应,消耗H+和产生CO2的物质的量之比为5:4,则该混合物中碳酸盐与碳酸氢盐的物质的量之比为( )
A.1:3
B.2:3
C.3:4
D.4:5难度: 中等查看答案及解析
-
下列气态氢化物稳定性最好的是( )
A.氯化氢
B.氨
C.磷化氢
D.氟化氢难度: 中等查看答案及解析
-
下列用途中应用了氮气的稳定性的是:( )
A.以氮气为原料之一制造硝酸
B.合成氨气后,制氮肥
C.金属焊接时的保护气
D.镁可以和氮气反应难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.硝酸可放在无色的带玻璃塞的细口瓶中
B.氢氧化钠溶液可盛在带胶塞玻璃瓶
C.大量氯气泄漏时,用氨水浸湿毛巾捂住嘴和鼻,并迅速离开现场
D.实验室常将氢氟酸保存在带磨口玻璃塞的细口玻璃瓶中难度: 中等查看答案及解析
-
在无色透明的溶液中可以大量共存的离子组是( )
A.H+、K+、ClO-、SO32--
B.OH-、Cl-、Na+、NH4+
C.Fe2+、NO3-、Cl-、H+
D.Mg2+、K+、Cl-、NO3-难度: 中等查看答案及解析
-
下列情况会对人体健康造成危害的是( )
A.用SO2漂白食品
B.用食醋清洗热水瓶胆内壁附着的水垢
C.提倡广泛使用铁锅
D.用小苏打发酵面团制作馒头难度: 中等查看答案及解析
-
北京2008年奥运会金牌“金镶玉”环形玉壁由昆仑玉制成,昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,则其用二氧化硅和金属氧化物的形式可表示为( )
A.CaO•MgO•SiO2•H2O
B.2CaO•5MgO•8SiO2•H2O
C.2CaO•MgO•SiO2•2H2O
D.5CaO•2MgO•8SiO2•H2O难度: 中等查看答案及解析
-
某中学一实验小组组装了下列所示实验装置,其中能达到实验目的是( )
A.
分离碘酒中的碘和酒精
B.
实验室制氨气
C.
除去Cl2中的HCl
D.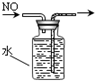
排出集气法收集NO难度: 中等查看答案及解析
-
铜粉加入稀盐酸中,加热无现象,这时加入一种盐则铜粉溶解而溶液变蓝,同时有气体放出,这种盐是( )
A.NaCl
B.KNO3
C.FeCl2
D.Fe2(SO4)3难度: 中等查看答案及解析
-
密度为0.91g•cm-3的氨水,质量百分比浓度为25%(即质量分数为0.25),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度( )
A.等于12.5%
B.大于12.5%
C.小于12.5%
D.无法确定难度: 中等查看答案及解析
-
室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系是( )
A.a=4b+3c
B.a=4b+c
C.a:b=4:1
D.a:b=4:3难度: 中等查看答案及解析
-
以下物质间的每步转化通过一步反应能实现的是( )
A.Al-Al2O3-Al(OH)3-NaAlO2
B.Fe-FeCl2-Fe(OH)2-Fe(OH)3
C.S-SO3-H2SO4-MgSO4
D.N2-NO2-HNO3-NO难度: 中等查看答案及解析
-
某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92g铜粉微热,反应后放出一氧化氮气体约为( )
A.0.02mol
B.0.01mol
C.0.015mol
D.无法计算难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值.下列叙述中正确的是( )
A.11.2L的NO气体中含有的原子总数为NA
B.标准状况下,22.4LSO2中所含分子数为NA
C.0.5L1mol•L-1的Na2SO4溶液中,阴阳离子总数为NA
D.12g金属镁变为镁离子时失去的电子数为NA难度: 中等查看答案及解析
-
氮化铝(AlN)广泛应用于电子、陶瓷等工业等领域.在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C
2AlN+3CO.下列叙述正确的是( )
A.AlN中氮的化合价为+3
B.上述反应中,N2是还原剂,Al2O3是氧化剂
C.AlN的摩尔质量为41g
D.上述反应中,每生成1molAlN需转移3mol电子难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.硫酸铵溶液与氢氧化钡溶液共热:NH4++SO42-+Ba2++OH-BaSO4↓+NH3↑+H2O
B.氯化铵溶液中加入稀氢氧化钠:NH4++OH-=NH3•H2O
C.氯化铵固体和熟石灰共热:NH4++OH-NH3↑+H2O
D.碳酸铵溶液中通入足量二氧化碳:CO32-+CO2+H2O=2HCO3-难度: 中等查看答案及解析
-
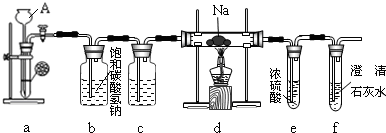
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )

A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.用大理石和稀盐酸制取二氧化碳:2H++CO32-=CO2↑+H2O
B.钠投入水中:2Na+2H2O=2Na++2OH-+H2↑
C.氧化铝与氢氧化钠反应:Al2O3+OH-=AlO2-+H2O
D.向稀硝酸溶液中加入过量的铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O难度: 中等查看答案及解析
-
已知气体的摩尔质量越小,扩散速度越快.右图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环.下列关于物质甲、乙的判断正确的是( )

A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水难度: 中等查看答案及解析
-
某无色溶液能与硅作用生成H2,则溶液中不可能大量共存的离子组是( )
A.H+、Ba2+、Mg2+、Cl-
B.Cl-、CO32-、Cu2+、Mg2+
C.NO3-、SO42-、K+、Na+
D.NO3-、OH-、Ba2+、Cl-难度: 中等查看答案及解析
-
在8NH3+3Cl2=6NH4Cl+N2反应中,若有2mol N2生成,发生氧化反应的物质和该物质的量是( )
A.16molNH3
B.8molNH3
C.4molNH3
D.3molNH3难度: 中等查看答案及解析
-
取0.4mol Cu2S与足量的浓硝酸完全反应,则参加反应的硝酸中被还原的硝酸为( )
A.0.8mol
B.1.6mol
C.2.4mol
D.4mol难度: 中等查看答案及解析
-
氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )
A.NH4H是离子化合物,固态时属离子晶体
B.NH4H溶于水,所形成的溶液显酸性
C.NH4H固体投入少量的水中,有两种气体产生
D.NH4H与水反应时,NH4H是氧化剂难度: 中等查看答案及解析
-
在强酸性溶液中可发生如下反应,该反应可定性地检验Mn2+的存在:2Mn2++5R2O8x-+8H2O
16H++10RO42-+2MnO4-
在反应中充当氧化剂的R2O8x-(假设氧元素化合价不变)中,元素R的化合价是( )
A.+4
B.+5
C.+6
D.+7难度: 中等查看答案及解析