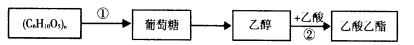
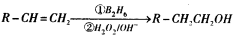-
已知体积为2L的恒容密闭容器中发生反应: ,请根据化学反应的有关原理同答下列问题
,请根据化学反应的有关原理同答下列问题
(1)一定条件下,充入2 mol SO2(g)和2 mol O2(g),20 s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为____,此时,该密闭容器内混合气体的压强是反应前的____倍。
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)____。
①
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各气体的浓度都不再发生变化
(3)下图表示该反应的速率(v)随时间(t)的变化的关系。则下列不同时间段中,SO3的百分含量最高的是( )
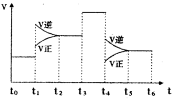

据图分析:你认为t3时改变的外界条件可能是________;
t6时保持体积不变向体系中充人少量SO3,再次平衡后
SO2的体积百分含量比t6时________(填“大”\“小”或“等于”)。
(4)下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器分别发生反应。
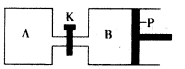
已知起始时容器A和B的体积均为aL。试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转
化率为____
②若打开K,一段时间后重新达到平衡,容器B的体积为__________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(5)已知单质硫的燃烧热为△H=-296kJ/mol,经测定由S(s)生成120gSO3(g)可放热592.5kJ,请写出SO2(g)氧化生成SO3(g)的热化学方程式____。
-
某溶液含有K+、Cu2+、Fe3+、Al3+、Fe2+、Cl—、CO2—3、OH—、NO—3、SO2—4中的几种,已知该溶液中各离子物质的量浓度均为0.2mol/L(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
I.取少量溶液,加入KSCN溶液时无明显变化:
Ⅱ.取原溶液加入BaCl2溶液,有白色沉淀生成;
Ⅲ.另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类没有增加。
请推断:
(l)仅由操作I及现象可得出的结论是____。
(2)仅由操作Ⅱ及现象可得出的结论是____。
(3)由操作Ⅲ及现象可得出溶液中一定含有的阳离子是____(写离子符号)。操作Ⅲ中发生反应的化学方程式为____。
(4)结合三步操作及题干已知,你认为原溶液中所含离子种类共有____种。
(5)另取l00mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为________g,写出此过程中涉及氧化还原反应的化学方程式____。
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,在碱性溶液中NaClO2比较稳定,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
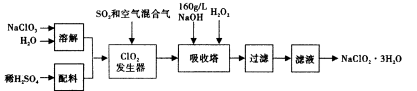
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 g NaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为____。若要计算该溶液的质量分数,还需要的一个条件是____(用文字说明)。
(2)发生器中鼓入空气的作用可能是____(选填序号)。
a.将SO2氧化成SO3,增强酸性;
b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为____。吸收塔的温度不能超过20℃,其目的是________。
(4)吸收塔中应维持NaOH稍过量,理由是____。
(5)吸收塔中能否用FeCl2代替H2O2____(填能.否)?理由是____。
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____(选填序号)。
A.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是____(填操作名称)。
-
已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26。
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
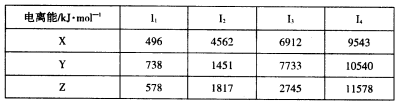
回答下列问题:
(1)B元素原子核外已成对电子数是未成对电子数的____倍。
(2)X、Y、Z的电负性从大到小的顺序为____(用元素符号表示)。
(3)分子式为A2B、A2E的两种物质中__________更稳定(用化学式表示),原因是____。
(4)X的氯化物的熔点比Y的氯化物的熔点____,原因是____。
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为____。等电子体指的是原子总数相同.价电子总数相同的分子.离子或基团,据此定义写出离子SCN—的一种等电子体____。
(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为- 20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)5的晶体类型为________。F元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如
图所示。在面心立方晶胞中F原子的配位数为____,体心立方晶胞的密度可表示为____。(F的原子半径为r)

-
有机物G(分子式为 C13H18O2)是一种香料,其合成路线如下图所示。其中A是一种相对分子质量为70的烃,核磁共振氢谱有四个峰且峰面积之比为6:2:1:1;B是一种芳香族含氧衍生物,相对分子质量在100-130之间,B中含氧元素的质量分数为13.1%,F可以使溴的四氯化碳溶液褪色。
已知: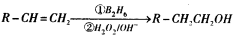

请回答下面的问题:
(1)化合物A的结构简式为____,按系统命名法命名的名称是____。
(2)化合物B的分子式为____,B在上图转化中发生的反应所属的反应类型是____。
(3)写出D→E反应的化学方程式____。
(4)写出C与E生成G反应的化学方程式____。
(5)E的同分异构体有多种,写出符合下列条件的所有物质的结构简式____。
a.属于芳香族化合物且苯环上的一氯代物有两种;b.含有“ ”基团
”基团