-
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体难度: 中等查看答案及解析
-
垃圾分类有利于资源回收利用.下列垃圾归类不合理的是( )
①
②
③
④垃圾 废易拉罐 废塑料瓶 废荧光灯管 不可再生废纸 垃圾分类 


A.①
B.②
C.③
D.④难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.麦芽糖及其水解产物均能发生银镜反应
B.用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
D.用甘氨酸()和丙氨酸(
)缩合最多可形成4种二肽
难度: 中等查看答案及解析
-
结合图判断,下列叙述正确的是( )

A.I和II中正极均被保护
B.I和II中负极反应均是Fe-2e-=Fe2+
C.I和II中正极反应均是O2+2H2O+4e-=4OH-
D.I和II中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀难度: 中等查看答案及解析
-
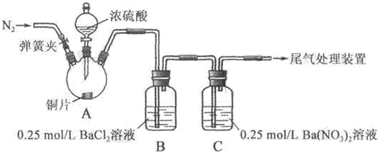
下列与处理方法对应的反应方程式不正确的是( )
A.用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓
B.用催化法处理汽车尾气中的CO和NO:CO+NOC+NO2
C.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2OAl(OH)3(胶体)+3H+
D.用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+)O2
xCO2+
H2O
难度: 中等查看答案及解析
-
25℃、101kPa下:①2Na(s)+
O2(g)=Na2O(s)△H=-414kJ•mol-1②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1下列说法正确的是( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s)△H=-317kJ•mol-1难度: 中等查看答案及解析
-
已知反应:2CH3COCH3(l)⇌CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
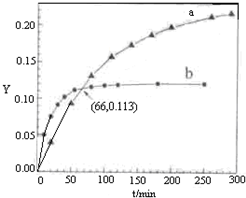
A.b代表0℃下CH3COCH3的Y-t曲线
B.反应进行到20min末,CH3COCH3的
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的难度: 中等查看答案及解析

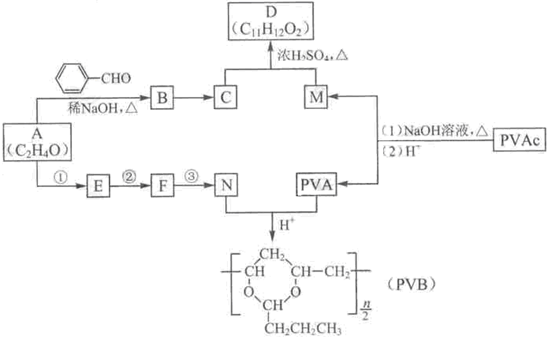
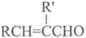 +H2O(R、R’表示烃基或氢)
+H2O(R、R’表示烃基或氢)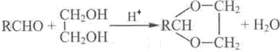
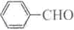 合成B的化学方程式是______.
合成B的化学方程式是______.