-
下列溶液一定呈酸性的是
A.pH<7的溶液 B.c(H+)>c(OH—) 的溶液
C.pH>7的溶液 D.c(H+)<c(OH—) 的溶液
难度: 简单查看答案及解析
-
下列说法正确的是
A.放热反应一定能自发进行,吸热反应一定不能自发进行
B.化学反应的反应热不仅与体系的始态和终态有关,也与反应的途径有关
C.催化剂不仅能加快反应速率,也能增大反应物的转化率
D.升高温度,能提高活化分子百分数,不能提高反应所需的活化能
难度: 简单查看答案及解析
-
下列关于原电池、电解池的叙述中正确的是
A.发生氧化反应的电极分别为负极和阴极
B.阴离子分别向负极和阴极迁移
C.电子流向分别由负极直接流向正极、阴极直接流向阳极
D.若都有一个电极质量减轻,应分别为负极和阳极
难度: 中等查看答案及解析
-
已知在某密闭容器中发生反应 4NH3+5O2=4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则下列关系正确的是
A.
υ(NH3) =υ(O2) B.
υ(O2) =υ(H2O)
C.
υ(NH3) =υ(H2O) D.
υ(O2) =υ(NO)
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.某离子被沉淀完全是指该离子在溶液中的浓度变为0
B.某物质的溶解性为难溶,则该物质的溶解度为0
C.一般来说,溶解度小的难溶物容易转化为溶解度大的难溶物
D.沉淀的生成、溶解和转化其实质都是沉淀发生了溶解平衡的移动
难度: 简单查看答案及解析
-
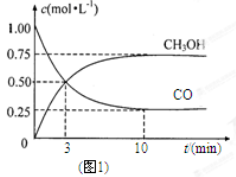
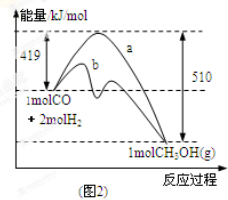
已知反应 ①
②稀溶液中,
,下列结论正确的是
A.碳的燃烧热△H为110.5kJ/mol
B.2molC(s)和1molO2(g)的能量比2molCO(g)的能量高221kJ
C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量
难度: 中等查看答案及解析
-
铅蓄电池的电池反应为 Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l),下列说法错误的是
A.放电时覆盖PbO2的电极为正极,发生还原反应
B.放电时电解质溶液中的H+向正极移动
C.充电时阴极的电极反应为 PbSO4(s) + 2e-=Pb(s) + SO42-(aq)
D.充电时电解质溶液的pH逐渐增大
难度: 中等查看答案及解析
-
有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在30 mL处,把管中的溶液全部放出,承接在量筒中溶液的体积是
A.等于30mL B.等于20mL C.大于20mL D.大于30mL
难度: 简单查看答案及解析
-
一定温度下,氯化银在水中存在溶解平衡 AgCl(s)
Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
A.③>①>②>④ B.②>①>④>③
C.④>③>②>① D.①>③>④>②
难度: 中等查看答案及解析
-
若常温下溶液中由水电离产生的c (OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是:
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
难度: 中等查看答案及解析
-
若将反应:Zn+H2SO4= ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是
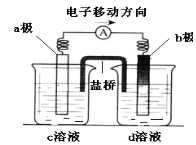
A.d溶液是稀硫酸 B.c溶液颜色变蓝
C.b极发生氧化反应 D.a极是铜棒
难度: 中等查看答案及解析
-
在密闭容器中发生如下反应:mA(g)+nB(g)
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
A.m+n<p B.平衡向逆反应方向移动
C.A的转化率降低 D.C的体积分数增加
难度: 简单查看答案及解析
-
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
下面有关电化学的图示,完全正确的是
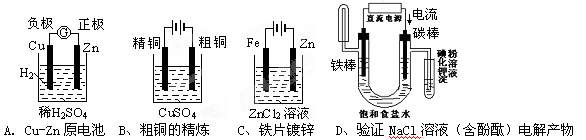
难度: 困难查看答案及解析
-
反应C(s)+H2O(g)⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半
③保持体积不变,充入N2 ④保持压强不变,充入N2.
A.①④ B.①③ C.③ D.②③
难度: 中等查看答案及解析
-
下列说法正确的是
A.某有机物的结构简式为:
,按官能团分,既可属于醇类,也可属于烯类
B.
的名称为2-甲基-3-丁烯
C.用分液的方法分离乙酸和乙酸乙酯
D.用重结晶的方法提纯苯甲酸
难度: 中等查看答案及解析
-
某烃在光照的条件下与氯气反应能生成三种不同的一氯代物,1 mol它在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下),它该烃的结构简式是

难度: 中等查看答案及解析
-
下列有机化合物的分类不正确的是
A
B
C
D
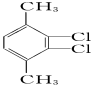
苯的同系物
芳香化合物
烯烃
醇
难度: 简单查看答案及解析