-
在通常条件下,下列各组物质的性质排列正确的是( )
A.熔点:CO2>KCl>SiO2
B.水溶性:HCl>H2S>SO2
C.沸点:乙烷>戊烷>丁烷
D.热稳定性:HF>H2O>NH3难度: 中等查看答案及解析
-
下列有关物质检验的实验结论正确的是( )
选项 实 验 操 作 及 现 象 实 验 结 论 A 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中一定含有SO42- B 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 该溶液中一定含有Fe2+ C 将某气体通入品红溶液中,品红溶液褪色 该气体一定是SO2 D 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 该物质一定属于醛类
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列说法正确的是( )
A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
C.乙酸与乙醇的混合液可用分液漏斗进行分离
D.用标准盐酸滴定待测NaOH溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低难度: 中等查看答案及解析
-
下列推断合理的是( )
A.明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色难度: 中等查看答案及解析
-
广东正在建设海洋强省.下列说法不正确的是( )
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属难度: 中等查看答案及解析
-
警犬常从案发现场的人体气味来获取有用线索.人体气味的成分中含有以下化合物:①辛酸;②壬酸;③环十二醇;④5,9-十一烷酸内酯;⑤十八烷;⑥己醛;⑦庚醛.下列说法正确的是( )
A.①②⑥分子中碳原子数小于10,③④⑤分子中碳原子数大于10
B.①②是无机物,③⑤⑦是有机物
C.①②⑥⑦都是酸性化合物
D.②③④含氧元素,⑤⑥⑦不含氧元素难度: 中等查看答案及解析
-
已知NaCl的摩尔质量为58.5g•mol-1,其晶体密度为d g•cm-3,若右图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示( )
A.117a3d
B.
C.
D.难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-Mn2++2H2O+Cl2↑
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+难度: 中等查看答案及解析
-
在相同状况下,下列两个反应放出的热量分别用Q1、Q2表示:H2(g)+
O2(g)═H2O(g),2H2(g)+O2(g)═2H2O(l),则Q1和Q2的关系正确的是( )
A.Q1>Q2
B.Q1=Q2
C.Q1<Q2
D.Q1=Q2
难度: 中等查看答案及解析
-
下列有关实验操作的说法正确的是( )
A.可用25ml碱式滴定管量取20.00mlKMnO4溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的,液体也不能蒸干
D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全难度: 中等查看答案及解析
-
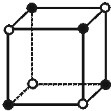
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,X、Y、Z分别处于立方体的顶点、棱边的中点、立方体的体心.则下面表示该化合物的化学式正确的( )

A.ZXY3
B.ZX2Y6
C.ZX4Y8
D.ZX8Y12难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol,Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g);△H=-226kJ/mol根据以上热化学方程式判断,下列说法正确的是( )

A.CO的燃烧热为283 kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g);△H>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.FeCl2溶液:K+、Na+、SO42-、AlO2-
D.=0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.溴乙烷与6mol/L的氢氧化钠水溶液共热:C2H5Br+OH-CH2=CH2↑+Br-+H2O
B.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O
C.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1~2滴盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O
D.在H2O2中加入酸性高锰酸钾溶液:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O难度: 中等查看答案及解析
-
石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,平面结构如图所示.则x值为( )

A.8
B.12
C.24
D.60难度: 中等查看答案及解析
-
将一定体积稀硝酸溶液平均分为两份,一份与足量的铜粉反应收集到气体体积为V1;另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到气体的体积为V2(V1和V2都在同一条件下测定),已知V2=3V1,则稀硝酸和稀硫酸的物质的量浓度之比( )
A.1:1
B.1:2
C.1:3
D.无法确定难度: 中等查看答案及解析