-
中华传统文化博大精深,其中涉及到很多的化学知识。下列有关说法不正确的是
A. 中国的圆珠笔头一直需要进口笔尖钢,经过5 年数不清的失败,2016年9月,中国太钢集团利用家常和面原理在钢水中加入添加剂试验成功,造出圆珠笔头,可完全替代进口,由此信息可知笔尖钢为合金,且具有良好的切削性。
B. 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料
C. 《天工开物》中有“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的矾指的是金属硫化物
D. 中国蓝是古代人工合成的蓝色化合物,其化学式为BaCuSi4O10,可改写成BaO·CuO·4SiO2
难度: 困难查看答案及解析
-
下列实验结论或推论正确的是
选项
实验操作
相应实验现象
结论或推论
A
溴水中加入苯,充分振荡、静置
水层几乎呈无色
苯与溴发生了反应
B
一小粒金属钠投入装有无水乙醇的试管中
反应结束前一段时间,钠浮在乙醇表面
密度:乙醇大于钠
C
分别向盛有KI3溶液的a、b试管中滴加淀粉溶液和AgNO3溶液
a中溶液变蓝,b中产生黄色沉淀
KI3 溶液中存在:I3-
I2 + I-
D
分别向含Mn2+的草酸溶液X和不含Mn2+的草酸溶液Y中滴加酸性高锰酸钾溶液
高锰酸钾溶液在溶液X中褪色较快
Mn2+也能还原高锰酸钾
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列关于有机物的说法不正确的是
A. 相同条件下的沸点:丙三醇>乙二醇>乙醇>乙烷>甲烷
B. 将浸透了石蜡油的石棉放在大试管底部,大试管中加入碎瓷片,加强热,将产生的气体持续通入溴的四氯化碳溶液中,红棕色逐渐变浅,最终褪色
C. —C3H7和—C2H5O各取代苯分子中的一个氢原子形成的二元取代物的同分异构体有24种
D. 薄荷醇
中至少有12个原子共平面
难度: 困难查看答案及解析
-
已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C均含有10个电子。它们之间转化关系如图所示。下列说法正确的是
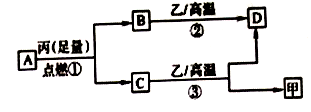
A. 原子半径:Z>Y>X B. 稳定性:A>C
C. 反应②和③均为吸热反应 D. X、Y、Z可以形成离子化合物
难度: 困难查看答案及解析
-
新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示。下列说法正确的是
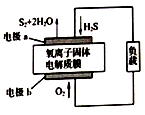
A. 电极b为电池负极
B. 电路中每流过4mol电子,正极消耗44.8LH2S
C. 电极b上的电极反应为:O2+4e-+4H+=2H2O
D. 电极a上的电极反应为:2H2S+2O2--4e-=S2+2H2O
难度: 困难查看答案及解析
-
两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
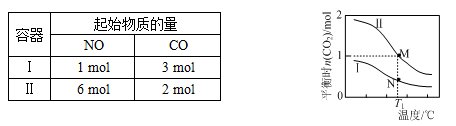
A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
难度: 困难查看答案及解析
-
某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 mol•L-1的混合溶液中逐滴加入10-4 mol•L-1的Na2S溶液,Zn2+先沉淀
难度: 困难查看答案及解析
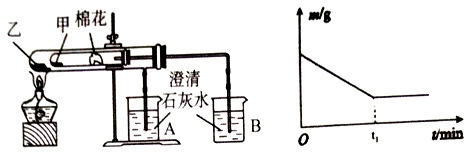

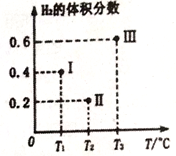
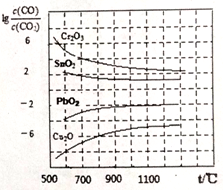
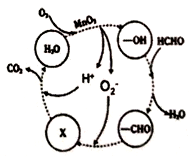
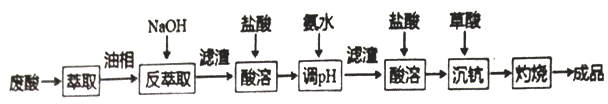
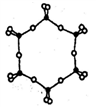

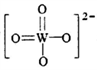 ,该离子中,σ键和π键的个数比是_____________。
,该离子中,σ键和π键的个数比是_____________。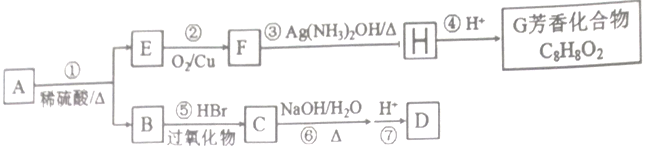 己知:I、G的苯环上一氯代物只有两种:
己知:I、G的苯环上一氯代物只有两种: RCH2CH2Br
RCH2CH2Br