-
从化学试剂商店买来的浓硝酸试剂瓶上所贴的危险化学品标志是

难度: 简单查看答案及解析
-
下列物质中,不属于电解质的是
A.CO2 B.NaCl C.H2SO4 D.KOH
难度: 中等查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是
A.NaOH溶液 B.稀H2SO4 C.CuSO4溶液 D.Fe(OH)3胶体
难度: 简单查看答案及解析
-
下列物质所属类别不正确的是
A.纯碱——碱 B.氯化铝——盐
C.金属钠——还原剂 D.二氧化硅——酸性氧化物
难度: 简单查看答案及解析
-
下列变化需要加入还原剂才能实现的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列各组离子能大量共存的是
A.
、
、
、
B.
、
、
、
C.
、
、
、
D.
、
、
、
难度: 中等查看答案及解析
-
氨是一种重要的化工原料。下列关于氨气性质的描述不正确的是
A.有刺激性气味、密度比空气小 B.遇氯化氢产生白烟
C.能使湿润的蓝色石蕊试纸变红 D.其水溶液能使酚酞溶液变红
难度: 中等查看答案及解析
-
下列关于Na2O2的说法中,不正确的是
A.浅黄色固体 B.可用作供氧剂
C.与H2O反应时,H2O作还原剂 D.与H2O反应时,放出热量
难度: 中等查看答案及解析
-
等质量的下列物质中,所含分子数最少的是
A.H2 B.HCl C.NH3 D.CH4
难度: 中等查看答案及解析
-
下列反应既属于离子反应,又属于氧化还原反应的是
A.CaO+H2O=
B.
C.
D.
难度: 中等查看答案及解析
-
下列关于Na2CO3和NaHCO3的说法中,不正确的是
A.均为白色固体 B.受热均易分解
C.其水溶液均显碱性 D.均能与硫酸反应
难度: 中等查看答案及解析
-
只用下列试剂中的一种,就能将FeCl3、NH4Cl和NaCl三种溶液区别开的是
A.KSCN溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
难度: 中等查看答案及解析
-
下列关于SO2的叙述中,正确的是
A.SO2的摩尔质量是64 g
B.1mol SO2中含氧原子数约为6.02×1023
C.常温常压下,1 mol SO2的体积为22.4L
D.常温常压下,64 g SO2的物质的量为1 mol
难度: 中等查看答案及解析
-
硫酸钾和硫酸铝的混合溶液中,Al3+的浓度为0.4 mol/L,
的浓度为0.7 mol/L,则K+的物质的量浓度为
A.0.1 mo/L B.0.15 mol/L C.0.2 mol/L D.0.3 mol/L
难度: 中等查看答案及解析
-
下表中各组物质不能实现如图转化的是

甲
乙
丙
A
Al
B
C
D
难度: 中等查看答案及解析
-
下列行为符合安全要求的是
A.金属钠着火时,立即用沾水的毛巾覆盖
B.配制稀硫酸时将水倒入浓硫酸中并不断搅拌
C.不慎洒出的酒精在桌上着火时,立即用水扑灭
D.大量氯气泄漏时,迅速离开现场并尽量往高处去
难度: 中等查看答案及解析
-
下列说法不正确的是
A.标准状况下,11.2 L CO2的质量为22 g
B.0.1 mol Cl2与足量水反应转移电子0.2 mol
C.18 g H2O含有的原子总数为3×6.02×1023
D.0.5 mol/L Na2SO3溶液中Na+的物质的量浓度为1.0 mol/L
难度: 中等查看答案及解析
-
解释下列事实的离子方程式不正确的是
A.Cu与浓H2SO4反应放出气体:
B.用大理石与稀盐酸制备CO2:
C.稀H2SO4与BaCl2溶液反应生成沉淀:
D.盛放NaOH溶液的试剂瓶不能用玻璃塞:
难度: 中等查看答案及解析
-
如图所示装置能使反应Zn+H2SO4=ZnSO4+H2↑的氧化反应和还原反应分别在锌片和铜片上进行,所以电流计指针发生了偏转。下列说法不正确的是

A.锌片发生氧化反应
B.铜片上有气体产生
C.电子由铜片通过导线流向锌片
D.铜片上发生反应
难度: 中等查看答案及解析
-
下列有关实验操作和现象描述的对应关系正确的是
A.向AlCl3溶液中逐滴加入氨水,产生白色沉淀后消失
B.向Na2SiO3溶液中逐滴加入稀盐酸,产生白色胶状物
C.将NaOH溶液逐滴滴入FeSO4溶液中,只观察到白色沉淀
D.将砂纸打磨过的铝箔加热至熔化,熔化的铝以小液滴的形式滴落下来
难度: 中等查看答案及解析
-
完成下列实验所选择的装置或仪器不正确的是
A
B
C
D
实验
分离水和酒精
用铵盐和碱制取氨气
用排空气法收集二氧化氮
用自来水制取蒸馏水
装置或仪器
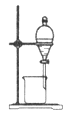

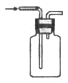
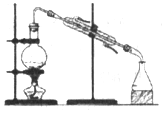
难度: 中等查看答案及解析


