-
下列物质的使用不涉及化学变化的是( )
A. 用铁质容器盛放浓硝酸 B. 液氨用作制冷剂
C. 氢氟酸刻蚀玻璃 D. 生石灰作干燥剂
难度: 简单查看答案及解析
-
下列反应既是氧化还原反应又是离子反应的是( )
A. 用CO还原氧化铁来炼铁 B. 用KMnO4和浓盐酸反应制氯气
C. 用稀硫酸除铁锈 D. SO2通入澄清石灰水变浑浊
难度: 简单查看答案及解析
-
下列有关金属的说法正确的是( )
A. Na久置于空气中最终生成NaHCO3
B. Mg比Al活泼,更易与NaOH溶液反应生成H2
C. 水蒸气通过灼热的铁粉有红棕色固体生成
D. 多数合金比各成分金属熔点低,硬度大
难度: 简单查看答案及解析
-
下列各组溶液中的离子能大量共存的是( )
A. NH、Ba2+、Cl-、OH- B. K+、NH4+、Cl-、SO
C. H+、SO
、NO、Cl- D. Ba2+、Br-、CO
、Na+
难度: 简单查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
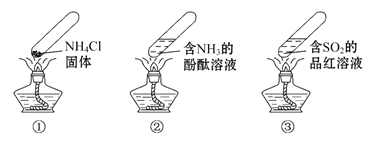
A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. 碳酸氢钠溶液与少量澄清石灰水反应:HC
+Ca2++OH-CaCO3↓+H2O
B. 氯化铵与氢氧化钠两种溶液混合加热:N
+OH-
H2O+NH3↑
C. 钠和冷水反应:Na+2H2ONa++2OH-+H2↑
D. 向氯化铝溶液中滴加过量氨水:Al3++3OH-Al(OH)3↓
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述不正确的是( )
A. 常温下,0.1molFe与足量稀硫酸反应,转移电子数目为0.2NA
B. 3.2g由O2和O3组成的混合物中含有的原子数目为0.2NA
C. 在过氧化钠与水的反应中,每消耗0.1mol过氧化钠,转移电子的数目为0.1NA
D. 在KClO3+6HCl(浓) ===KCl+3Cl2↑+3H2O反应中,若产生标准状况下6.72LCl2时,转移电子数目为0.6NA
难度: 中等查看答案及解析
-
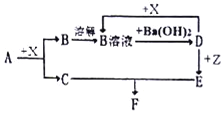
如图为含有同一种元素的a、b、c、d四种物质的转化关系.其中a是单质,b、c是氧化物,d是酸,各步转化均为一步实现,则a可能是①C ②N2 ③S ④Si中的( )

A. ①和③ B. 只有④ C. ①②③ D. ①②③④
难度: 中等查看答案及解析
-
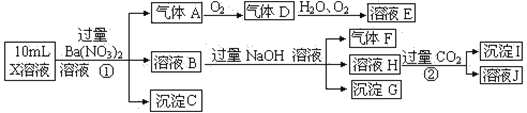
下列除去杂质(括号中的物质为杂质)的方法中,不正确的是( )
A. FeCl3溶液(FeCl2):通入适量Cl2
B. Fe2O3固体(Al2O3):加入烧碱溶液,过滤
C. Cl2气体(HCl):通过NaOH溶液洗气后干燥
D. Na2CO3固体(NaHCO3):加热
难度: 中等查看答案及解析
-
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A. 盐酸 B. 烧碱溶液 C. 氨水 D. KSCN溶液
难度: 中等查看答案及解析
-
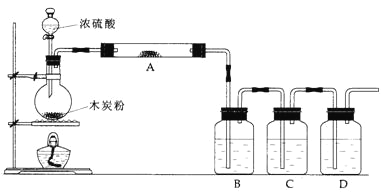
实验室抽取少量干燥的氨气涉及下列装置,其中正确的是

A. ①是氨气发生装置 B. ②是氨气吸收装置
C. ③是氨气发生装置 D. ④是氨气收 集、检验装置
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B.硫粉在过量的氧气中燃烧可以生成SO3
C.将少量SO2通入BaCl2溶液能生成白色沉淀
D.将浓盐酸、浓硝酸和浓硫酸分别露置在空气中,溶质的物质的量浓度都降低
难度: 中等查看答案及解析
-
下列陈述I、Ⅱ正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
浓硝酸的挥发性
浓硝酸应保存在棕色瓶中
B
氧化铝的熔点很高
氧化铝用来制造耐火坩埚
C
氯气具有强氧化性
氯气可用作漂白剂
D
NH4Cl溶液和氨水均能导电
NH4Cl和氨水均是电解质
难度: 中等查看答案及解析
-
等物质的量的下列物质与足量稀硝酸反应,放出NO气体的物质的量最多的是( )
A. Fe B. FeO C. Cu D. Fe3O4
难度: 简单查看答案及解析
-
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100ml,已知溶液中阳离子的浓度相同,且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为
A. 11.2g B. 6.8g C. 19.6g D. 22.4g
难度: 中等查看答案及解析
-
某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( )
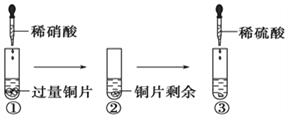
A. ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B. ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4===4CuSO4+2NO↑+4H2O
C. ③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D. 由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
难度: 中等查看答案及解析
-
镁铁混合物5.1g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量为( )
A. 5.4g B. 6.8g C. 10.2g D. 12g
难度: 中等查看答案及解析
-
在200mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.3mol/L,Cl-的物质的量浓度为1.5mol/L。要使Mg2+全部转化为沉淀分离出来,至少需要加入 4mol/L NaOH溶液的体积为( )
A. 30mL B. 60mL C. 90mL D. 110mL
难度: 中等查看答案及解析
-
将10mL充满NO2和O2混合气体的试管倒立在水槽中,反应停止后试管剩余2mL O2,原混合气体中NO2的体积为( )
A. 8.2mL B. 5.6mL C. 6.4mL D. 9.2mL
难度: 中等查看答案及解析
-
把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为( )
A. 1︰1 B. 2︰5 C. 4︰1 D. 3︰1
难度: 中等查看答案及解析