-
下列变化一定属于化学变化的是( )
①风化 ②变色 ③燃烧 ④爆炸 ⑤白磷转变成红磷 ⑥工业制氧气 ⑦久置氯水变成无色 ⑧分馏 ⑨NO2气体冷却后颜色变浅 ⑩潮解.
A.①②③④⑦
B.③④⑤⑦
C.①③④⑦⑩
D.①③⑤⑦⑨难度: 中等查看答案及解析
-
下列有关物质的性质与应用不相对应的是( )
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
C.SO2具有氧化性,可用于漂白纸浆
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.1.2 g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA
B.100 mL 18.4 mol•L-1硫酸与足量铜反应,生成SO2的分子数为0.92 NA
C.1 L 1 mol•L-1的K2CO3溶液中离子总数小于3NA
D.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的是( )
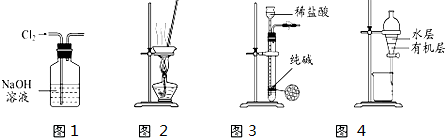
A.用图1 所示装置除去Cl2中含有的少量HCl
B.用图4所示装置分离,CCl4萃取碘水后已分层的有机层和水层
C.用图3 所示装置制取少量纯净的CO2气体
D.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体难度: 中等查看答案及解析
-
用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是( )
A.试样中加入酚酞作指示剂,用标准酸液进行滴定
B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
C.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
D.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定难度: 中等查看答案及解析
-
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g•cm-3,溶质的质量分数为w,其中含NH3的物质的量为b mol.下列叙述中正确的是( )
A.溶质的质量分数为w=×100%
B.溶质的物质的量浓度c=mol•L-1
C.溶液中c(OH-)=mol•L-1
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w难度: 中等查看答案及解析
-
向10mL 0.1mol•L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( )
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
B.x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)难度: 中等查看答案及解析
-
下列有机化合物中均含有酸性杂质,除去这些杂质的方法中正确的是( )
A.过滤乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液
B.乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液
C.乙醛中含乙酸杂质:加入氢氧化钠溶液洗涤,分液
D.苯中含苯酚杂质:加入溴水难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+2Fe3++3H2O
B.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+难度: 中等查看答案及解析
-
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,下列叙述不正确的是( )
A.咖啡鞣酸与浓溴水既能发生取代反应又能发生加成反应
B.咖啡鞣酸分子中与苯环直接相连的原子都在同一平面上
C.1 mol咖啡鞣酸在碱性条件下水解时,可消耗8 mol NaOH
D.咖啡鞣酸的分子式为C16H18O9难度: 中等查看答案及解析
-
图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
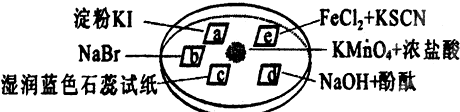
对实验现象的“解释或结论”正确的是( )选项 实验现象 解释或结论 A a处变蓝,b处变红棕色 氧化性:Cl2>Br2>I2 B c处先变红,后褪色 氯气与水生成了酸性物质 C d处立即褪色 氯气与水生成了漂白性物质 D e处变红色 还原性:Fe2+>Cl-
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-难度: 中等查看答案及解析
-
下列离子或分子组中能大量共存,且满足相应要求的是( )
选项 离子或分子 要求 A K+、NO3-、Cl-、HS- c(K+)<c(Cl-) B Fe3+、NO3-、SO32-、Cl- 滴加盐酸立即有气体产生 C NH4+、Al3+、SO42-、CH3COOH 滴加NaOH溶液立即有气体产生 D Na+、HCO3-、Mg2+、SO42- 滴加氨水立即有沉淀产生
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
将Na2O2、HCl和Al2O3一起溶于一定量的水中,完全反应后,测得所得溶液中只含有Na+、AlO2-、Cl- (不考虑AlO2-的水解和H2O的电离),则Na2O2、HCl、Al2O3的物质的量之比不可能是( )
A.2:2:1
B.3:3:1
C.3:4:1
D.4:6:1难度: 中等查看答案及解析
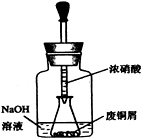


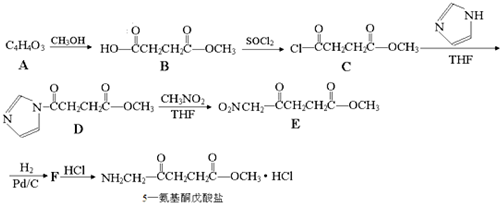
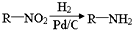
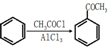 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、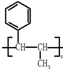 单体的合成路线流程图(无机试剂任选).
单体的合成路线流程图(无机试剂任选).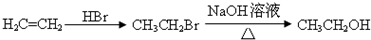 ______.
______.