-
化学与生产、生活和社会可持续发展密切相关,下列有关叙述正确的是( )
A.在食品袋中放入装有硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质
B.天然气、酒精和汽油分别属于化石能源、不可再生能源和二次能源
C.夏天雷雨过后会使人感觉空气清新,这是因为空气中产生了少量的二氧化氮
D.酸雨样品露天放置一段时间pH减小,是由于酸雨所含成分被氧化的原因
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.测定相同温度下盐酸和醋酸溶液的pH,可证明盐酸是强酸、醋酸是弱酸
B.改变温度能改变任何可逆反应的平衡状态
C.离子反应的结果是自由移动的离子浓度减小
D.Fe(OH)3胶体和饱和FeCl3溶液都呈红褐色,可通过丁达尔效应区分二
难度: 中等查看答案及解析
-
下列叙述中,错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.甲苯与氯气在光照下反应主要生成2,4,6—三氯甲苯
难度: 中等查看答案及解析
-
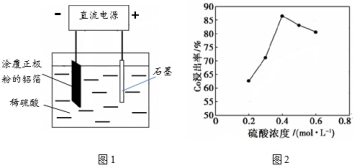
镁电池毒性低、污染小,电压高且平稳,它逐渐成为人们研究绿色电池的关注焦点。其中一种镁电池的反应原理为:xMg+ Mo3S4
MgxMo3S4,下列说法正确的是( )
A.放电时Mo3S4发生氧化反应
B.放电时,正极反应式为:Mo3S4 + 2xe- = Mo3S42x-
C.充电时,电路中通过2mol电子时,可消耗1mol Mg
D.充电时,Mg2+向负极移动
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.1mol NaHSO4晶体含有2NA个离子
B.1L2mol/L明矾溶液经水解可得到氢氧化铝胶体粒子的数目为2NA个
C.1mol CH3+(碳正离子)中含有的电子数为10NA
D.在O2参与的反应中,1molO2 作氧化剂时得到的电子数一定是4NA
难度: 简单查看答案及解析
-
关于下图所示转化关系(X代表卤素),说法不正确的( )
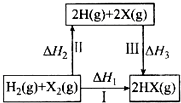
A.H2(g)+X2(g) = 2H(g)+2X(g) △H2>0
B.若X 分别表示Cl、Br、I,则过程Ⅱ吸收的热量依次减少
C.生成HX的反应热与途径有关,所以△H1≠△H2+△H3
D.Cl2、Br2 分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K2,则K1>K2
难度: 简单查看答案及解析
-
已知X、Y、Z、W、R五种元素,原子序数依次增大,且原子序数都小于20,X元素的原子是所有元素中原子半径最小的,Y、W同主族,Z、W同周期,Y元素原子的最外层电子数是次外层的3倍,Z、R是同周期中金属性最强的元素。下列说法不正确的是( )
A.原子半径:X<Y<Z<W<R
B.由X、Y、Z、W四种元素组成的化合物既含有共价键又含离子键
C.沸点:X2Y>X2W
D.Y与W形成的化合物WY2是形成酸雨的主要物质之一
难度: 中等查看答案及解析