-
关于下列过程熵变的判断不正确的是( )
A.溶解少量食盐于水中,
B.纯碳和氧气反应生成
C.H2O(g)变成液态水,
D.CaCO3(s)加热分解为CaO和CO2(g),
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- = 4OH -
B.铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4(S) -2e - + 2H2O(l)=PbO2(S) + 4H+(aq)+ SO42-(aq)
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- = Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - = Fe2+
难度: 中等查看答案及解析
-
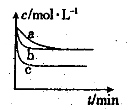
250C时,0.1mol·L-1稀醋酸加水稀释,如图中的纵坐标y可以是( )
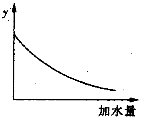
A.溶液的pH B.醋酸的电离平衡常数
C.溶液的导电能力 D.醋酸的电离程度
难度: 中等查看答案及解析
-
在下列溶液中,能大量共存的离子组是( )
A.能使pH试纸显蓝色的溶液中:
B.常温下
的溶液中:
C.含有大量Al3+的溶液中:
D.常温下pH为7的溶液中:
难度: 中等查看答案及解析
-
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大 ②溶液的pH<7
③溶液中c(Na+)=c(A2-) ④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
A.①②④ B.①③④ C.①③ D.②④
难度: 中等查看答案及解析
-
能正确表示下列反应的离子反应方程式为( )
A.惰性电极电解MgCl2溶液:2Cl- +2H2O
2OH- +Cl2↑ +H2↑
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
C.HS-的电离:
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温下,醋酸钠与醋酸的混合溶液PH=7,C(Na+)>c(CH3COO-)
B.0.1mol/LNa2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
C.将PH=6的H2SO4稀释1000倍后,c(H+)=2c(SO42-)
D.0.1mol/LNaHCO3溶液中:c(Na+)+c(H+)= c(HCO3-)+ c(OH-)+2c(CO32-)
难度: 中等查看答案及解析
-
下列液体均处于25℃,下列有关叙述正确的是( )
A.PH值相同的盐酸和氯化铵溶液中水的电离程度相同
B.某溶液中由水电离出的c(H+)=10-13,则该溶液的PH一定为13
C.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍
D.中和浓度和体积均相同的盐酸和醋酸,消耗的氢氧化钠的物质的量之比为1:1
难度: 中等查看答案及解析
-
下述实验不能达到预期实验目的的是( )
序号
实验内容
实验目的
A
将2.5gCuSO4·5H2O溶解在97.5g水中
配制质量分数为1.6%的CuSO4溶液
B
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液
说明一种沉淀能转化为另一种溶解度更小的沉淀
C
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
D
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
难度: 中等查看答案及解析
-
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡:
,下列说法正确的是( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
难度: 中等查看答案及解析
-
实验室用标准盐酸测定未知浓度NaOH溶液,用甲基橙作指示剂,下列操作可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准酸液润洗
B.开始时酸式滴定管尖嘴部分留有气泡,滴定过程中消失
C.锥形瓶内溶液颜色由黄变橙时立即停止滴定
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
难度: 中等查看答案及解析
-
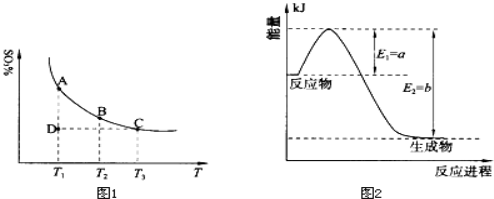
可逆反应
,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
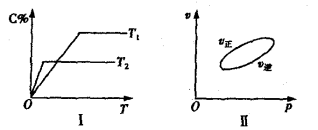
A.T1<T2,Q>0 B.增大压强,物质B的转化率增大
C.反应达平衡后,增加少量的D,平衡逆向移动 D.a+b>c+d
难度: 中等查看答案及解析
-
反应mA(g)+ nB(g)
pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3 mol/L,又测得平均反应速率v(C)=2v(B)。达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( )
A.2A(g)+ 6B(g)
3C(g)+5D(g) B.3A(g)+ B(g)
2C(g)+2D(g)
C.3A(g)+ B(g)
2C(g)+ D(g) D.A(g)+ 3B(g)
2C(g)+2D(g)
难度: 中等查看答案及解析
-
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,则下列叙述正确的是 ( )
A.用该电池电解CuCl2溶液产生2.24LCl2时,有0.2mol电子转移
B.金属锂作电池的负极,石墨作电池的正极,加入硫酸可提高电解质的导电性
C.电池工作(放电)过程中,SOCl2被还原为Li2SO3
D.电池工作过程中,负极消耗的锂与正极生成的硫质量之比为7:8
难度: 中等查看答案及解析
-
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )
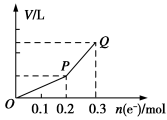
A.0.15 mol CuO B.0.1 mol CuCO3
C.0.075mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3
难度: 中等查看答案及解析
-
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO+5I-+3H2O,下列说法不正确的是( )
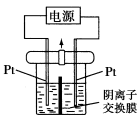
A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH-
B.电解结束时,右侧溶液中含有IO3-
C.电解槽内发生反应的总化学方程式:KI+3H2O
KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变
难度: 中等查看答案及解析