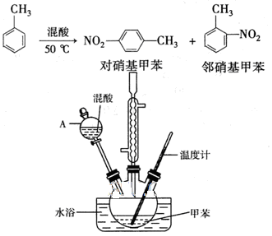
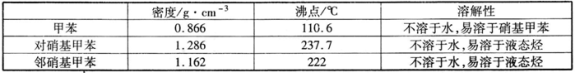
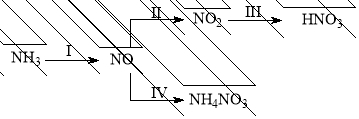
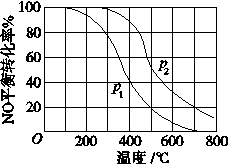
-
化学与社会、生活密切相关。对下列现象或事实解释错误的是
选项
现象或事实
解释
A
明矾用于净水
铝离子水解产生的胶体具有很强吸附杂质的作用
B
SO2能使品红溶液褪色
SO2具有漂白性
C
“地沟油”禁止食用,但可以用来制肥皂
“地沟油”主要成分为油脂属于酯类可以发生皂化反应
D
用氯水和淀粉溶液鉴别食盐是否加碘
目前加碘食盐中含碘元素物质为KI
难度: 中等查看答案及解析
-
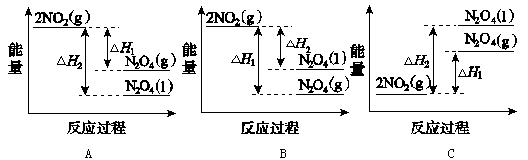
含有一个碳碳双键的烯烃,加氢后产物的结构简式为右图,这种烯烃可能的结构有(不考虑立体异构)
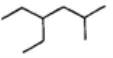
A.5种 B.6种 C.7种 D.8种
难度: 中等查看答案及解析
-
下列装置或操作能达到实验目的的是
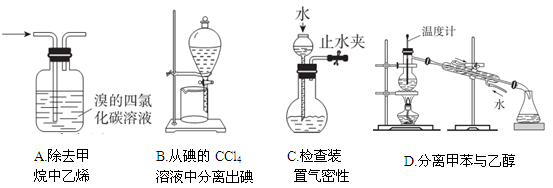
难度: 中等查看答案及解析
-
在温度t1和t2下,卤素单质X2(g)和H2反应生成HX的化学平衡常数如下表,仅根据下表数据不能判断的是
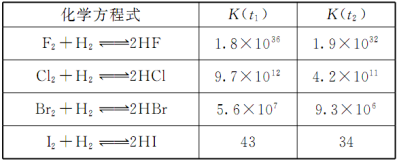
A.已知t2>t1,HX的生成反应为放热反应
B.在相同条件下, X2平衡转化率:F2>Cl2
C.X2与H2反应的剧烈程度随着原子序数递增逐渐减弱
D.HX的稳定性:HBr>HI
难度: 中等查看答案及解析
-
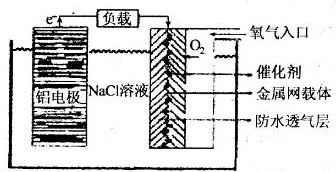
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是
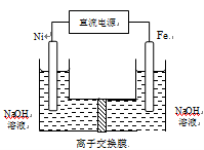
A.铁是阳极,电极反应为Fe-2e-+2OH-
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.每制得1mol Na2FeO4,理论上可以产生67.2L气体
D.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液
有白色沉淀生成
该溶液中一定含有Ag+
B
向AgNO3溶液中滴加过量氨水
溶液澄清
Ag+与NH3∙H2O能大量共存
C
用石墨作电极电解MgSO4溶液
某电极附近有白色沉淀生成
该电极为阳极
D
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置
下层溶液显紫红色
氧化性:Fe3+>I2
难度: 中等查看答案及解析
-
室温时,关于溶液的下列说法正确的是
A.常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性
B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在
C.往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中
增大
D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3⑤NH4HCO3中c(CO32-)的大小关系为:②>④>③>⑤>①
难度: 中等查看答案及解析