-
下列说法正确的( )
A. 含有共价键的化合物一定是共价化合物 B. 分子中只有共价键的化合物一定是共价化合物 C. 离子化合物中只能含离子键 D. 只有非金属原子间才能形成共价键
难度: 中等查看答案及解析
-
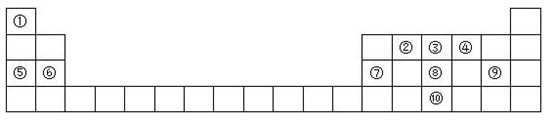
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是( )
A. 元素周期表有18个族
B. 元素周期表的第8、9、10三纵列合称Ⅷ族,Ⅷ族是元素周期表所有族中元素种类最多的族
C. 一般在过渡元素中寻找一些化学反应新型催化剂
D. 元素周期表中的所有副族元素都是金属元素,副族包含过渡元素和Ⅷ族
难度: 简单查看答案及解析
-
下列微粒中与NH4+具有相同质子数和电子数的是( )
A. H3O+ B. H2O C. Ne D. OH-
难度: 简单查看答案及解析
-
重水(2H2O)是重要的核工业原料,下列说法不正确的是( )
A. 氘(2H)原子核内有1个质子 B. 1H与2H是不同的核素
C. 1H218O与2H216O的相对分子质量相同 D. 1H2O与2H2O互为同素异形体
难度: 中等查看答案及解析
-
0.75 mol RO
中共有30 mol电子,则R在元素周期表中的位置是( )
A. 第2周期ⅤA族 B. 第3周期ⅣA族
C. 第2周期ⅥA族 D. 第3周期ⅦA族
难度: 中等查看答案及解析
-
下列表示物质或微粒的化学用语正确的是( )
A. HF的电子式为
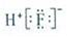
B. 质子数为35,中子数为45的溴原子:
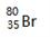
C. Na2O2的电子式为:

D. 氯原子的结构示意图为:
难度: 中等查看答案及解析
-
下列反应属于放热反应的是( )
A. 氢氧化钡晶体和氯化铵晶体的反应 B. 生成物总能量低于反应物总能量的反应 C. 化学键断裂吸收的热量比化学键生成放出的热量多的反应 D. 不需要加热就能发生的反应
难度: 简单查看答案及解析
-
有A、B、C、D四种短周期元素,其简单离子A+、B2+、C-、D2-的电子层结构相同.则下列比较中正确的是( )
A. 原子序数:A>B>C>D B. 离子半径:A+>B2+>C->D2- C. 氢化物稳定性:H2D>HC D. 金属性:A>B
难度: 困难查看答案及解析
-
在不同条件下,分别测得反应2SO2(g)+O2(g)⇌2SO3(g)的速率如下,其中化学反应速率最快的是( )
A. v(SO2)=4 mol·L-1·min-1 B. v(O2)=2 mol·L-1·min-1
C. v(SO3)=6 mol·L-1·min-1 D. v(O2)=1 mol·L-1·min-1
难度: 简单查看答案及解析
-
下列过程中,只破坏共价键的是( )
A.酒精溶于水
B.HCl溶于水得盐酸
C.将Na2SO4熔融呈液态
D.从NH4HCO3中闻到了刺激性气味
难度: 简单查看答案及解析
-
下列各组物质均既有离子键又有共价键的是( )
A. KOH、H2SO4、NH4Cl B. CaO、Na2CO3、NH4HCO3
C. K2O2、NaOH、K2SO4 D. HClO、Al2O3、MgCl2
难度: 简单查看答案及解析
-
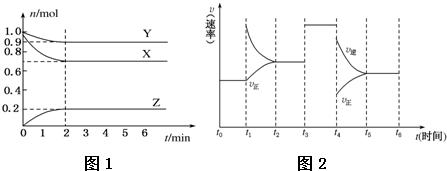
短周期元素X、Y、Z、W、R的化合价与原子序数的关系如下图所示.下列说法不正确的是( )
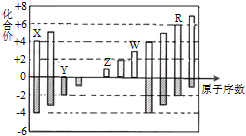
A. X、Y都存在同素异形现象
B. 工业上常用W的氧化物为原料制取单质W
C. Z和Y形成的化合物中只存在离子键
D. 常温下单质W不能溶于R的最高价氧化物对应水化物的浓溶液
难度: 中等查看答案及解析
-
常温下,分别将四块形状相同且质量均为7g的铁块同时投入下列四种溶液中,产生气体的速率最快的是
A.1000mL2mol/LHCl B.500mL4mol/L H2SO4
C. 50ml3mol/LHCl D. 50mL18.4mol/L H2SO4
难度: 简单查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的
A.CaCO3(s) B.Na2SO4溶液
C.KNO3溶液 D.CuSO4(s)
难度: 中等查看答案及解析
-
锶被广泛应用于电子、化工、冶金、轻工、医药和光学等领域.下列关于锶(Sr)元素单质及其化合物的叙述中不正确的是( )
A. 锶(Sr)位于周期表中第5周期第IIA族
B. 金属锶单质呈银白色,具有良好的导电性
C. 氢氧化锶碱性弱于氢氧化镁的碱性
D. 硝酸锶是离子化合物,易溶于水
难度: 中等查看答案及解析
-
为将反应2Al+6H+=2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜)( )。
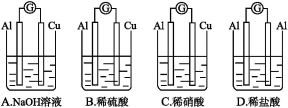
难度: 中等查看答案及解析
-
下图曲线a表示放热反应X(g)+Y(g)⇌Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )

A. 减压 B. 加大X的投入量 C. 升高温度 D. 减小体积
难度: 中等查看答案及解析
-
某元素的一种同位素X 的质量数为A,含N个中子,它与1H 原子组成HmX分子,在ag HmX 中所含质子的物质的量是
A.
(A-N+m)mol B.
(A-N)mol
C.
( A-N)mol D.
(A-N+m)mol
难度: 困难查看答案及解析
-
实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是( )
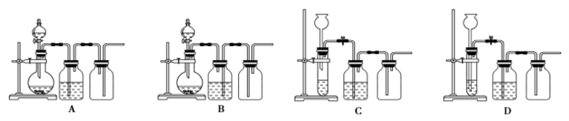
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是
A、a为负极,是铁片,烧杯中的溶液为硫酸
B、b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C、a为正极,是碳棒,烧杯中的溶液为硫酸
D、b为正极,是碳棒,烧杯中的溶液
为硫酸铜溶液
难度: 中等查看答案及解析