-
据报道,科学家新合成了一种抗癌、治癌的药物,其化学式可表示为10B20。下列叙述正确的是
A. 10B20为硼元素的一种原子 B. 10B20为硼元素的一种单质
C. 10B20的中子数比核外电子数多 D. 10B20的原子核外电子排布为
难度: 中等查看答案及解析
-
下列各组物质中,互为同素异形体的是
A. T2O与D2O B. O2和O3
C. 4019K与4020Ca D. 21H和31H
难度: 简单查看答案及解析
-
下列晶体或分子中,含有化学键类型有差异的一组是
A. NH3、NO2 B. NaCl、KF C. NaOH、Ca(OH)2 D. MgO、H2O2
难度: 中等查看答案及解析
-
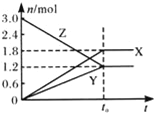
X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2-的核外电子层结构相同。下列说法不正确的是
A. 离子半径:X+> Y3+> Z2- B. 碱性:XOH > Y(OH)3
C. 单质的还原性:X > Y D. 原子序数:Y > X > Z
难度: 中等查看答案及解析
-
化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )
A. 能够节约原料和能源 B. 能够提高产品的产量
C. 能够提高经济效益 D. 能够提高化学反应速率
难度: 中等查看答案及解析
-
反应 A + 3B
2C + 2D 在四种不同条件下的反应速率为:(1)v(A)=0.3mol/(L·s) (2)v(B)=0.6mol/(L·s) (3)v(C)=0.4mol/(L·s) (4)v(D)=0.45mol/(L·s),则该反应速率的快慢顺序为( )
A. (2)>(4)>(3)>(1) B. (2)>(3)=(4)>(1)
C. (1)>(4)>(2)=(3) D. (4)>(3)>(2)>(1)
难度: 简单查看答案及解析
-
在一定温度下,反应A2(g)+B2(g)
2AB(g)达到平衡的标志是( )
A. 单位时间内生成n molA2同时生成n molAB
B. 容器内的总物质的量不随时间变化
C. 单位时间内生成2n molAB的同时生成n molB2
D. 单位时间内生成n molA2的同时生成n molB2
难度: 简单查看答案及解析
-
下列变化过程,属于放热反应的是( )
①碳与水蒸气生成一氧化碳和氢气 ② 酸碱中和反应
③铝粉与氧化铁粉末反应 ④ 固体NaOH溶于水
⑤ H2在Cl2中燃烧 ⑥ 碳酸钙高温分解
A. ②③④⑤ B. ②④⑤ C. ②③⑤ D. ①③⑤
难度: 简单查看答案及解析
-
下列关于实验现象的描述不正确的是( )
A. 铜锌组成的原电池中电子是从锌经过导线流向铜
B. 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C. 把铜片插入FeCl3溶液中,在铜片表面出现一层铁
D. 把锌片放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快
难度: 中等查看答案及解析
-
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是( )

A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与生成
难度: 中等查看答案及解析
-
对于100mL0.5mol/LH2SO4溶液与铁片的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 1.0mol/LH2SO4溶液;③改用300mL 0.5mol/LH2SO4溶液;④用等量铁粉代替铁片;⑤改用质量分数为98%的H2SO4溶液
A. ①③④ B. ①②④ C. ①②③④ D. ①②③⑤
难度: 中等查看答案及解析
-
已知:1 mol H2(g)与1 mol Br2(g)完全反应生成2 mol HBr(g)时放出72 kJ的热量,有关物质的相关数据如下表:则表中a为( )
H2(g)
Br2(g)
HBr(g)
1 mol分子中的化学键断裂时需要吸收的能量/kJ
436
a
369
A. 404 B. 260 C. 230 D. 200
难度: 简单查看答案及解析
-
短周期元素R、X、Y、Z的原子序数依次增大。R和X可形成两种液态化合物(常温常压),Y+和X2-具有相同的电子层结构,X和Z位于同一主族。下列说法正确的是( )
A. 原子半径大小顺序为:r(Y)>r(X)>r(Z)>r(R)
B. R与X形成的两种液态化合物中均只含极性共价键
C. Y与X可形成碱性氧化物Y2X2
D. 由R、X、Y、Z四种元素形成的常见化合物是强电解质
难度: 中等查看答案及解析
-
在原子的第n电子层中,当n为最外层时,最多容纳电子数与(n-1)层相同;当n为次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10,则n层是( )
A. N层 B. M层 C. L层 D. K层
难度: 中等查看答案及解析
-
关于元素周期表和元素周期律的应用有如下叙述:其中正确的是( )
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料。
A. ①②③④ B. ②③④ C. ③④ D. ②③
难度: 简单查看答案及解析
-
化学与生活密切相关,下列有关说法错误的是( )
A. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟 起,乃真硝石也”,该方法应用了焰色反应
C. “笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,用石材制作砚台的过程是化 学变化
D. 利用铝制容器盛装浓硫酸的原因不是浓硫酸跟铝不反应,而是发生钝化
难度: 中等查看答案及解析