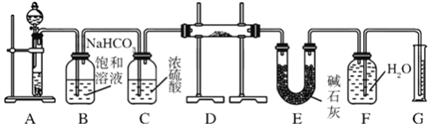
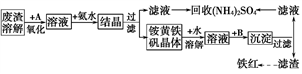
-
将NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液并用水溶解、加热,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应。则X为( )
A.ClO2 B.Cl2O C.Cl2 D.Cl2O3
难度: 中等查看答案及解析
-
下列物质既能跟盐酸反应,又能跟NaOH溶液反应的是
①SiO2 ②Al ③Al2O3 ④Al(OH)3
⑤Na2CO3溶液 ⑥Ca(HCO3)2溶液 ⑦NH4HCO3溶液 ⑧KHSO4溶液
A.④⑥⑦⑧ B.②③④⑥⑦ C.①②③④⑦ D.②③④⑤⑧
难度: 中等查看答案及解析
-
已知下列热化
学方程式:C(s)+O2(g) = CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g) = 2H2O(g) ΔH=-483.6 kJ·mol-1
现有0.2 mol的炭粉和氢气组成的气、固混合物在氧气中完全燃烧,共放出63.53 kJ热量,则炭粉与氢气的物质的量之比为
A.1:1 B.1:2 C.2:3 D.3:2
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A. 向稀HNO3中滴加Na2SO3溶液:SO
+2H+===SO2↑+H2O
B. 向Na2SiO3溶液中通入过量SO2:SiO
+SO2+H2O===H2SiO3↓+SO
C. Ca(ClO)2溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
D. 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O===4Na++2Cu(OH)2↓+O2↑
难度: 困难查看答案及解析
-
下列热化学方程式书写正确的是( )
A. S(s)+
O2(g)===SO3(g)ΔH=-315 kJ·mol-1(燃烧热) (ΔH的数值正确)
B. 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+
O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. 已知常温常压下:HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则有:H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
D. 已知:S(s)+O2(g)===SO2(g) ΔH1=-Q1 kJ·mol-1,S(g)+O2(g)===SO2(g) ΔH2=-Q2 kJ·mol-1,则Q1<Q2
难度: 中等查看答案及解析
-
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(s)。2 min时该反应达到平衡,生成了0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
A. x=1
B. 平衡时B与C的浓度之比为3∶2
C. 平衡时A与B的转化率相等,均为40%
D. 平衡时加入少量D可提高该反应的反应速率
难度: 中等查看答案及解析