-
下列有关离子键的说法正确的是
A. 阴、阳离子成键时只受到静电吸引力的作用
B. 原子通过电子的得失先形成阴阳离子后再成键
C. 任何离子键在形成的过程中必定有电子的得与失
D. 在离子化合物CaCl2中,两个氯离子之间也存在离子键
难度: 简单查看答案及解析
-
下列说法错误的是
A. 在共价化合物中一定含有共价键
B. 由非金属元素组成的化合物一定是共价化合物
C. 含有离子键的化合物一定是离子化合物
D. 双原子单质分子中的共价健一定是非极性键
难度: 中等查看答案及解析
-
下列说法中正确的是
A. KOH中含有离子键也含有共价键,属于离子化合物
B. HF中存在离子键,属于离子化合物
C. 含有共价键的化合物一定是共价化合物
D. 阴、阳离子间通过静电引力而形成的化学键叫做离子键
难度: 简单查看答案及解析
-
下列各组元素的原子间在形成化合物时容易形成共价键的是
原子
a
b
c
d
e
f
g
M层电子数
1
2
3
4
5
6
7
A. a和c B. a和f
C. d和g D. b和g
难度: 简单查看答案及解析
-
下列各组中每种物质都既有离子键又有共价键的一组是
A. NaOH H2SO4 (NH4)2SO4
B. MgO Na2SO4 HNO3
C. Na2O2 KOH Na3PO4
D. HCl Al2O3 MgCl2
难度: 简单查看答案及解析
-
下列分子的电子式书写正确的是 ( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化学用语书写正确的是
A. 氯离子的结构示意图:
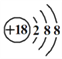
B. 作为相对原子质量测定标准的碳核素:
C. 氯化镁的电子式:
D. 用电子式表示氯化氢分子的形成过程:
难度: 简单查看答案及解析
-
(2017·江苏卷)下列有关化学用语表示正确的是
A. 质量数为31的磷原子:
B. 氟原子的结构示意图:
C. CaCl2的电子式:
D. 明矾的化学式: Al2(SO4)3
难度: 简单查看答案及解析
-
将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4。下列关于NaHSO4的说法正确的是
A. 因为NaHSO4是离子化合物,所以NaHSO4固体能够导电
B. NaHSO4固体中阳离子和阴离子的个数比是2∶1
C. NaHSO4固体熔化时破坏的是离子键和共价键
D. NaHSO4固体溶于水时破坏的是离子键和共价键
难度: 简单查看答案及解析
-
已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是

A. 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X)
B. Z的最高价氧化物对应水化物的酸性比W的强
C. X的简单气态氢化物的稳定性比W的弱
D. X分别与Y、Z形成的化合物中化学键类型相同
难度: 中等查看答案及解析