-
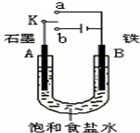
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中,只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X.这四种金属的活动性顺序是( )
A.Y>Z>W>X
B.Z>Y>W>X
C.W>Z>Y>X
D.X>Y>Z>W难度: 中等查看答案及解析
-
一种充电电池放电时的电极反应为:H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A.H2O的还原
B.NiO(OH)的还原
C.H2的氧化
D.Ni(OH)2的氧化难度: 中等查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同难度: 中等查看答案及解析
-
下列反应属于放热反应的是( )
①稀硫酸与氢氧化钾溶液反应
②锌与稀硫酸的反应
③生石灰变成熟石灰的反应
④消石灰和氯化铵晶体混合反应
⑤石灰石高温煅烧
⑥灼热的炭与CO2反应
⑦甲烷与O2的燃烧反应.
A.①②③⑤
B.①②③⑦
C.①②⑤⑥⑦
D.④⑥难度: 中等查看答案及解析
-
下列关于能量判据和熵判据的说法中,不正确的是( )
A.放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程
B.由能量判据和熵判据组合成的复合判据,将更适合于所有的过程
C.在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200 K)下则能自发进行
D.放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的难度: 中等查看答案及解析
-
下列有关平衡常数的说法中,正确的是( )
A.平衡常数为K=的反应,化学方程式为CO2+H2⇌CO+H2O
B.反应2NO2(g)⇌N2O4(g)△H<0,升高温度,该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D.改变条件,反应物的转化率增大,平衡常数也一定增大难度: 中等查看答案及解析
-
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示,图中的△H表示生成1mol产物的数据.已知PCl5分解为PCl3和Cl2是可逆反应.下列说法正确的是( )
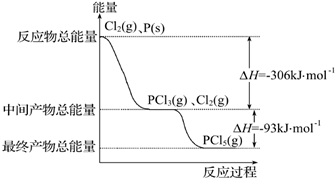
A.其他条件不变,升高温度有利于PCl5生成
B.反应2P(s)+5Cl2(g)═2PCl5(g)对应的反应热△H=-798 kJ•mol-1
C.P和Cl2反应生成PCl3的热化学方程式为2P(s)+3Cl2(g)═2PCl3(g)△H=-306 kJ•mol-1
D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,增大压强,PCl5的转化率减小,平衡常数K减小难度: 中等查看答案及解析
-
若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是( )
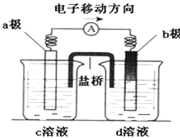
A.d溶液是稀硫酸
B.c溶液颜色变蓝
C.b极发生氧化反应
D.a极是铜棒难度: 中等查看答案及解析
-
下列方案中.能够使反应Cu+2H2O═Cu(OH)2↓+H2↑发生的是( )
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿的空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解硫酸铜溶液难度: 中等查看答案及解析
-
下列说法正确的是( )
A.钢铁发生电化学腐蚀时,负极发生的反应是:Fe-3e-═Fe3+
B.将钢铁与电源的正极相连,可防止其被腐蚀
C.在镀件上镀铜时可用金属铜作阴极
D.用电解法精炼粗铜时粗铜作阳极难度: 中等查看答案及解析
-
在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应:A(s)+2B(g)⇌C(g)+D(g)已达到平衡状态的是:( )
①混合气体的压强;②混合气体的密度;③B的物质的量浓度;④气体总物质的量;⑤混合气体的平均相对分子质量;⑥C、D反应速率的比值.
A.②③⑤
B.①②③
C.②③④⑥
D.①③④⑤难度: 中等查看答案及解析
-
下图有关电化学的示意图正确的是( )
A.
B.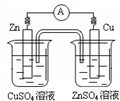
C.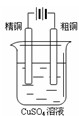
D.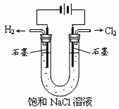
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)
2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应平衡常数不变难度: 中等查看答案及解析
-
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数值分别为:
下列有关叙述错误的是( )t℃ 700 800 830 1000 1200 K 1.67 1.11 1.00 0.60 0.38
A.该反应的化学方程式是:CO(g)+H2O(g)⇌CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO和H2O各1 mol,再把温度升高到830℃,此时测得CO2为0.4 mol时,这时可逆反应处于平衡状态
D.若平衡浓度关系符合=
,可判断此时温度是1000℃
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,不正确的是( )
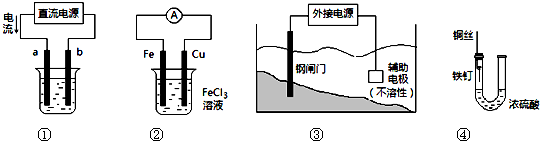
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀难度: 中等查看答案及解析
-
用二根铂丝作电极插入KOH溶液中,分别向两极通入甲烷和氧气,可作为一种燃料电池的模拟装置.试判断下列说法正确的是( )
A.通氧气的铂极为负极
B.此电池反应为CH4+2O2═CO2+2H2O
C.此电池放电时,KOH浓度减小
D.此电池放电时,电子由负极通过电解质溶液移向正极难度: 中等查看答案及解析
-
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-746.8kJ•mol-1,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是( )
A.当X表示温度时,Y表示平衡常数K
B.当X表示温度时,Y表示CO的转化率
C.当X表示N2的物质的量时,Y表示NO的转化率
D.当X表示NO的物质的量时,Y表示平衡常数K难度: 中等查看答案及解析
-
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
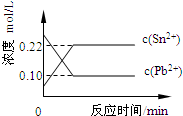
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2难度: 中等查看答案及解析