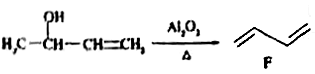-
明代《本草纲目》记载了民间酿酒的工艺“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离( )
A. 汽油和氯化钠溶液 B. 39%的乙醇溶液
C. 氯化钠与单质溴的水溶液 D. 硝酸钾和氯化钠的混合物
难度: 简单查看答案及解析
-
化学与生产、生活、社会密切相关。下列说法正确的是( )
A. 葡萄酒中添加SO2,可起到抗氧化和抗菌的作用
B. PM2.5颗粒分散到空气中可产生丁达尔效应
C. 苯、四氯化碳、乙醇都可作萃取剂,也都能燃烧
D. 淀粉、油脂、纤维素和蛋白质都是高分子化合物
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A. 25℃、l0IKPa下,NA个C18O2分子的质量为48g
B. 标准状况下,22.4L HF中含有的电子数为10NA
C. 1mol白磷(P4)分子中所含化学键的数目为4NA
D. 1L0.1 mol/L的NaClO水溶液中含有的氧原子数为0.l NA
难度: 中等查看答案及解析
-
下列有机反应:①甲烷与氯气光照反应 ②乙醛制乙酸 ③乙烯使溴水褪色 ④乙醇制乙烯 ⑤乙醛制乙醇 ⑥乙酸制乙酸乙酯 ⑦乙酸乙酯与NaOH溶液共热 ⑧液态植物油制人造脂肪 ⑨乙烯制乙醇的说法正确的是
A. ②⑤的反应类型相同 B. ⑥⑦的反应类型不同
C. ④与其他8个反应的类型都不同 D. ①③⑧属于同一种反应类型
难度: 简单查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题。下列化学反应先后顺序判断正确的是
A. 在含有等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B. 在含等物质的量的FeBr2、FeI2溶液中,缓慢通人氯气:I-、Br-、Fe2+
C. 在含等物质的量的KOH、Ba(OH)2溶液中,缓慢通入CO2: KOH、Ba(OH)2、K2CO3、BaCO3
D. 在含等物质的量的Fe3+、Cu2+、H+溶液中加入锌粉:Fe3+、Cu2+、H+
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、M的原子序数依次增大。元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下,M单质为淡黄色固体。下列说法不正确的是
A. X单质与M单质不能直接化合
B. Y的合金可用作航空航天飞行器材料
C. M简单离子半径大于Y2+的半径
D. X和Z的气态氢化物,前者更稳定
难度: 中等查看答案及解析
-
诺氟沙星别名氟哌酸,是治疗肠炎痢疾的常用药。其结构简式如右图,下列说法正确的是

A. 该化合物属于苯的同系物
B. 分子式为Cl6 H16 FN3O3
C. 1mol该化合物中含有6NA个双键
D. 该化合物能与酸性高锰酸钾、溴水、碳酸氢钠溶液反应
难度: 中等查看答案及解析
-
乙基环己烷(
)的一溴代物共有几种(不考虑立体异构)
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
根据下列实验现象所得出的结论正确的是
选项
实验现象
实验结论
A
将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈
稀硝酸的氧化性比浓硝酸的强
B
滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅
Na2CO3溶液中存在水解平衡
C
某溶液中滴加过量氨水产生白色沉淀且不溶解
该溶液中一定含有Mg2+
D
溴水中通入SO2,溴水褪色
SO2具有漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是
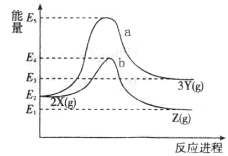
A. X→Y反应的活化能为E5
B. 加入催化剂曲线a变为曲线b
C. 升高温度增大吸热反应的活化能,从而使化学反应速率加快
D. 压缩容器体积不改变活化能,但增大单位体积活化分子数,使得反应速率加快
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. Na2S溶液中:SO42-、K+、Cl-、Cu2+
B.
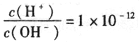 的溶液:K+、AlO2-、CO32-、Na+
的溶液:K+、AlO2-、CO32-、Na+C. 饱和氯水中:Cl-、NO3-、Na+、SO32-
D. 碳酸氢钠溶液:K+、SO42-、Cl-、H+
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+CO(g)
MgO(s)+CO2(g)+SO2(g) △H >0,该反应在某密闭容器中达到平衡。下列分析正确的是
A. 恒温恒容时,充入CO气体,达到新平衡时
增大
B. 容积不变时,升高温度,混合气体的平均相对分子质量减小
C. 恒温恒容时,分离出部分SO2气体可提高MgSO4的转化率
D. 恒温时,增大压强平衡逆向移动,平衡常数减小
难度: 中等查看答案及解析
-
已知:Mn(s)+O2(g)=MnO2(s) △H1
S(s)+O2(g)=SO2(g) △H2
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H3
下列表述正确的是
A. △H2>0 B. Mn+SO2 =MnO2 +S △H=△H1-△H2
C. △H3>△H1 D. MnO2(s)+SO2(g)=MnSO4(s) △H=△H3-△H2-△H1
难度: 简单查看答案及解析
-
常温下向10mL0.1mol/L的HR溶液中逐渐滴入0.1mol/L的NH3·H2O溶液, 所得溶液pH及导电性变化如图。下列分析不正确的是
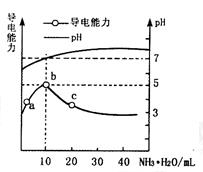
A.a~b点导电能力增强,说明HR为弱酸
B.b点溶液pH=7,说明NH4R没有水解
C.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)×c(OH-)=Kw=1.0×10-14
难度: 困难查看答案及解析

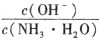 将_______(填“增大” “减小”或“无法确定”)。
将_______(填“增大” “减小”或“无法确定”)。
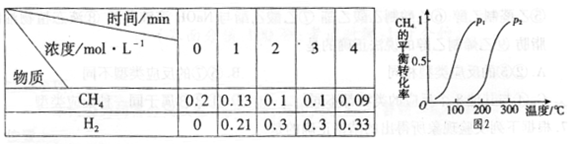
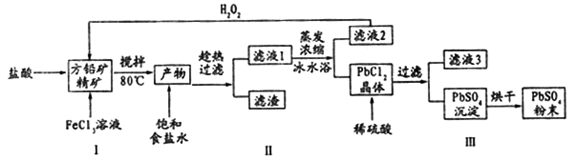
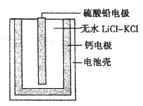
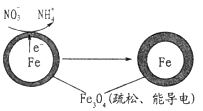

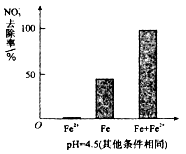
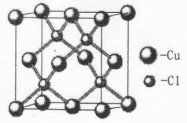
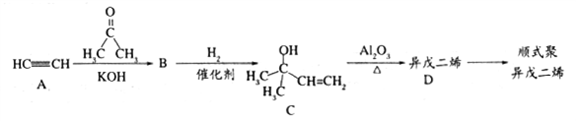
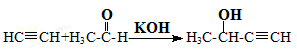 E
E