-
下列气体的制备和性质实验中,由现象得出的结论错误的是( )
选项
试剂
试纸或试液
现象
结论
A
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3为碱性气体
B
浓盐酸、浓硫酸
pH试纸
变红
HCl为酸性气体
C
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
氮氧化合物对环境的损害作用极大。下列环境问题中氮氧化合物不是“重要成员”的是
A. 酸雨 B. 光化学烟雾 C. 臭氧空洞 D. 温室效应
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. SO2具有氧化性,可用于漂白纸浆
B. NaHCO3能与碱反应,可用作焙制糕点的膨松剂
C. Fe2(SO4)3易溶于水,可用作净水剂
D. 液氨汽化时吸收大量的热,可用作制冷剂
难度: 中等查看答案及解析
-
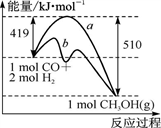
目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2 (g)+4H2(g)
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,下列表格中各物理量的变化判断正确的是
A. 正反应速率减小 B. 逆反应速率增大
C. 平均相对分子质量不变 D. 转化率增大
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 向FeCl3溶液中滴加HI溶液:Fe3++2I-===Fe2++I2
B. 用铜电极电解氯化钠溶液:2Cl-+2H2O
Cl2↑+H2↑+2OH-
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2 Na+
难度: 中等查看答案及解析
-
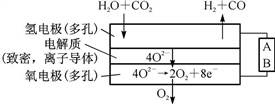
下列有关电化学的说法正确的是
A. 铜的金属活泼性比铁弱,可在海轮外壳上镶入若干铜块以减缓铁腐蚀
B. 原电池中,一定由活泼性强的金属作负极,发生氧化反应
C. 原电池放电时的负极和电解池充电时的阴极均发生氧化反应
D. 可充电电池充电时,负极与电源负极相连,正极与电源正极相连
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B. 已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ
C. 已知2C(s)+2O2(g)===2CO2(g) ΔH=a,2C(s)+O2(g)===2CO(g) ΔH=b,则a>b
D. 已知CH4(g)+H2O(g) === CO(g)+3 H2(g) ΔH=+206.1 kJ·mol–1,反应过程中使用催化剂,ΔH减小
难度: 中等查看答案及解析
-
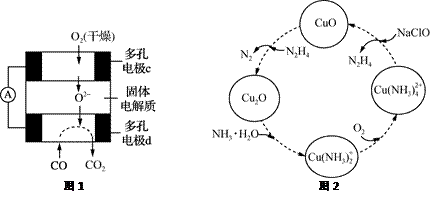
实验室制取下列气体的实验正确的是( )
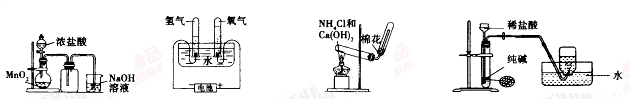
A. 实验室制氯气 B. 实验室制氧气 C. 实验室制氨气 D. 实验室制二氧化碳
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
A. S
SO3
H2SO4
B. NH3
N2
HNO3
C. SiO2
Si
SiCl4
Si
D. 海水
Mg(OH)2
Mg
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符合的是
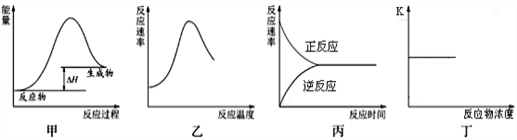
A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示可逆反应从加入反应物开始建立化学平衡的过程
D. 图丁表示可逆反应的平衡常数随反应物浓度的变化
难度: 中等查看答案及解析
-
阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,不正确的是
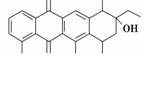
A. 阿克拉酮的分子式为C22H22O8
B. 分子中含有3个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质最多可与3 mol NaOH反应
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 mol·L-1 KSCN溶液中:Fe3+、NH4+ 、Br-、SO42 -
B.
=106的溶液中:NH4+ 、K+、AlO2- 、NO3-
C. 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42 -、Cl-
D. 0.1 mol·L-1 Ca(NO3)2溶液中:Na+、NH4+ 、CO32 -、CH3COO-
难度: 困难查看答案及解析
-
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B. pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(CO
)+c(HCO
)+c(H2CO3)
D. 0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
难度: 困难查看答案及解析
-
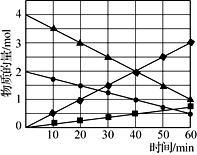
在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min
0
10
20
40
50
T1
n(CH4)/mol
0.50
0.35
0.25
0.10
0.10
T2
n(CH4)/mol
0.50
0.30
0.18
……
0.15
下列说法正确的是( )
A. T1时0~10 min NO2的平均反应速率为0.15 mol·L-1·min -1
B. T2时CH4的平衡转化率为70.0%
C. 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大
难度: 困难查看答案及解析
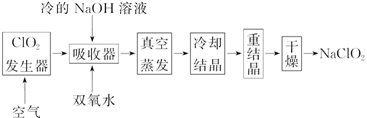
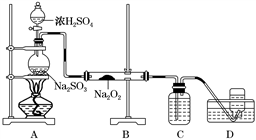
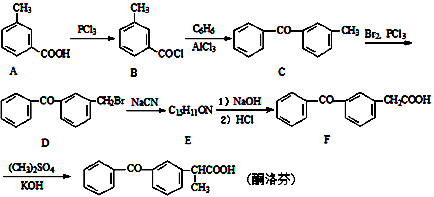
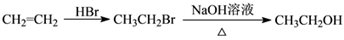 __________________________
__________________________