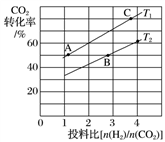
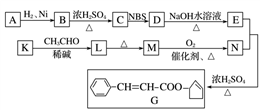
-
下列有关说法中不正确的是( )
A. 在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可使蛋白质变性,达到消毒的目的
B. 测定相同温度下盐酸和醋酸溶液的pH,就可证明盐酸是强酸、醋酸是弱酸
C. 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管
D. 食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 1mol18O中含有的中子数为9NA
B. 常温下,32g含有少量臭氧的氧气中含有的氧原子数为2NA
C. 若1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
D. 78g过氧化钠固体中所含阴、阳离子总数为4NA
难度: 中等查看答案及解析
-
下列对有机物结构的描述错误的是
A. 甲烷与氯气的混合气体在光照下生成的有机化合物均无同分异构体
B. 组成为C7H16的烷烃中仅能由一种单烯烃加氢而制得的有2种
C. 某烃的结构简式可表示为
(碳原子数≤10)。已知分子中有两种化学环境不同的氢原子,且数目之比为3∶2,则该烃一定是苯的同系物
D. 含5个碳原子的有机物,每个分子中最多可形成4个C—C键
难度: 困难查看答案及解析
-
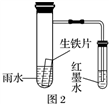
下列有关实验原理或操作正确的是( )
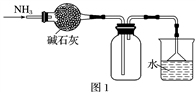
A. 图1所示的装置可用于干燥、收集并吸收多余的氨气
B. 用广泛pH试纸测得0.1mol·L-1NaClO溶液的pH值约为12
C. 用蒸发溶剂的方法将10%的Ca(HCO3)2溶液变为20%的Ca(HCO3)2溶液
D. 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀
难度: 中等查看答案及解析
-
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH
,模拟装置如图所示。下列说法正确的是( )

A. 阳极室溶液由无色变成棕黄色 B. 阴极的电极反应式为4OH--4e-===2H2O+O2↑
C. 电解一段时间后,阴极室溶液中的pH升高 D. 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
难度: 困难查看答案及解析
-
常温下,向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是( )
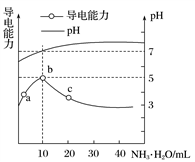
A. HR为强酸 B. a、b两点所示溶液中水的电离程度相同
C. b点溶液中c(NH
)>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
难度: 困难查看答案及解析
-
W、X、Y、Z是四种短周期元素,其原子序数依次增大。已知甲是由其中三种元素组成的化合物,25℃时0.1 mo1.L-1甲溶液的pH为13。X元素的气态氢化物可与其最高价氧化物对应的水化物反应生成盐。下列说法中,正确的是
A. 原子半径大小的比较:r(X)>r(Y)>r(Z)
B. 元素Y、Z的简单离子的电子层结构不同
C. 元素X的简单气态氢化物的热稳定性比元素Y的强
D. 只含W、X、Y三种元素的化合物中,有离子化合物,也有共价化合物
难度: 困难查看答案及解析
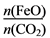 =6,则FexOy的化学式为________。
=6,则FexOy的化学式为________。