-
下列说法正确的是( )
A. KClO3和SO3溶于水后能导电,故KClO3和SO3为电
解质
B. HClO是弱酸,所以NaClO是弱电解质
C. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D. 杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
难度: 中等查看答案及解析
-
在2A+B
3C+4D中,表示该反应速率最快的是( )
A.v(A) = 0.7mol·L-1·S-1 B.v(B) = 0.3 mol·L-1·S-1
C.v(C) = 0.8mol·L-1·S-1 D.v(D) = 1 mol·L-1·S-1
难度: 简单查看答案及解析
-
能用勒沙特列原理解释的是( )
A.500℃左右比室温更有利于合成氨的反应
B.低压有利于合成氨的反应
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.实验室常用排饱和食盐水的方法收集氯气
难度: 简单查看答案及解析
-
下列关于电解质的电离平衡状态的叙述中,正确的是( )
A.弱电解质的电离达到平衡状态后,电离就停止了
B.弱电解质的电离达到平衡状态后,分子的消耗速率和离子的生成速率相等
C.弱电解质的电离达到平衡状态后,分子和离子的浓度相等
D.弱电解质的电离达到平衡状态后,外界条件改变,电离平衡可能要发生移动
难度: 中等查看答案及解析
-
将Mg条投入盛有稀HCl的容器里,产生H2的速率与下列因素有关系的是( )
①盐酸浓度 ②温度 ③镁条的表面积 ④容器的密闭情况 ⑤溶液中c(
Cl-)大小
A.①② B.③④ C.①②③ D.①②③④⑤
难度: 中等查看答案及解析
-
把0.05 mol NaOH固体分别加入到下列100 mL溶液中,导电能力变化较大的是( )
A.0.5 mol/L MgSO4溶液 B.0.5 mol/L盐酸
C.0.5 mol/L的CH3COOH溶液 D.0.5 mol/L NH4Cl溶液
难度: 中等查看答案及解析
-
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O
HCOO-+H3O+
B.CO2+H2O
HCO
+H+
C.CO
+H2O
HCO
+OH-
D.HS-+H2O
S2-+H3O+
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,
当下列物理量不再变化时,不能表明反应:A(s)+2B(g)
C(g)+D(g)已达平衡的是( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.混合气体的平均分子量
难度: 中等查看答案及解析
-
在一定温度下,将X和Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应:2X(g)+ Y(s)
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表下列说法正确的是( )
t / min
2
4
7
9
n(Y)/mol
0.12
0.10
0.09
0.09
A.反应前2min的平均速
率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,加入一定量的Y,反应速率一定加快
C.反应进行4s时,X的转化率75%
D.反应达到平衡时,X的物质的量浓度为0.02mol·L-1
难度: 困难查看答案及解析
-
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中不正确的是(忽略混合前后溶液体积变化)( )
A.溶液的pH值:②>③>①
B.水电离出的c(OH﹣):③>①>②
C.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO﹣)=0.1mol/L
D.②和③等体积混合后的溶液:c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
难度: 中等查看答案及解析
-
常温下,在10 mL 0.2 mol·L-1氨水中,滴入0.2 mol·L-1的稀盐酸,使溶液的pH=7。则下列说法正确的是( )
A.加入盐酸的体积大于10 mL B.c(NH
)=c(Cl-)
C.加入盐酸的体积等于10 mL D.c(NH
)<c(Cl-)
难度: 中等查看答案及解析
-
等物质的量浓度、等体积的下列物质的溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3
⑤(NH4)2CO3下列关系或者说法正确的是( )
A.c(CO
)的大小关系为②>⑤>③>④>①
B.c(HCO
)的大小关系为④>③>⑤>②>①
C.将溶液蒸干、灼烧后只有①不能得到对应的固体物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
难度: 困难查看答案及解析
-
可逆反应N2O4
2NO2 △H>0在密闭容器中反应,达到平衡
状态,要使混合气体颜色加深,可采取的方法是( )
①减小压强 ②缩小体积③升高温度④增大N2O4的浓度
A.①②③ B.②③④
C.①③④ D.①②③④
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO
)>c(NH
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
难度: 中等查看答案及解析
-
两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是( )
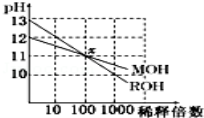
A.MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)=10 c(MOH)
D.稀释前MOH溶液和ROH溶液中由水电离出的c(OH﹣)后者是前者的 10倍
难度: 困难查看答案及解析
-
将1mol H2(g)和2mol I2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+ I2(g)
2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是( )
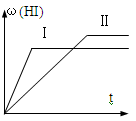
A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒温条件下,扩大反应容器体积
D.恒容条件下升高温度
难度: 困难查看答案及解析
