-
化学与人类生活、生产和社会可持续发展密切相关。下列说法错误的是( )
A.煤的气化、液化是使煤变成清洁能源的有效途径
B.高纯硅可制作太阳能电池,二氧化硅可制作光导纤维
C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
D.利用工业生产产生的二氧化碳制造全降解塑料,可以缓解温室效应
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色溶液中:K+、Na+、Cu2+、SO42-
B.c(H+)/c(OH-)=1×10-14的溶液:K+、Na+、Cl-、SiO32-
C.由水电离出的C(OH-)=1×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl-
D.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl-
难度: 中等查看答案及解析
-
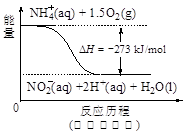
下列说法不正确的是( )
A.水解反应NH4++H2O
NH3·H2O+H+达到平衡后,升高温度平衡正向移动
B.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,该现象不足以说明Ksp(BaSO4)与Ksp(BaCO3)大小关系。
C.明矾水解生成Al(OH)3胶体,可用作净水剂
D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0
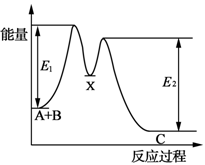
难度: 中等查看答案及解析
-
下列有关实验原理或实验操作正确的是( )

A.用干燥pH试纸测定某新制氯水的pH
B.用图1装置能除去SO2中混有的CO2
C.用图2装置能验证HCl气体在水中的溶解性
D.用25 mL碱式滴定管量取20.00 mLKMnO4 溶液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法中正确的是( )
A.在密闭容器中加入1 mol N2和3 mol H2,充分反应生成NH3分子数为2NA
B.标准状况下,22.4 L的CCl4分子中含有共价键数为4NA
C.常温常压下,1 mol NaHSO4晶体中含有2NA个离子
D.电解饱和食盐水,当阴极产生2.24L H2时,转移的电子数一定为0.2NA
难度: 中等查看答案及解析
-
据《华盛顿邮报》报道,美国食品与药物管理局近期公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如下图),并不会对婴儿或成人的健康构成威胁.关于双酚A的下列说法正确的是( )
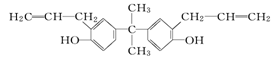
A.该有机物属于芳香族化合物,分子式为C21H24O2
B.该有机物分子中所有碳原子有可能在同一平面上
C.双酚A不能使溴水褪色,但能使酸性的高锰酸钾溶液褪色
D.双酚A的一氯取代物有三种
难度: 中等查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+) >c(OH-)=c(H+)
D.0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
难度: 困难查看答案及解析