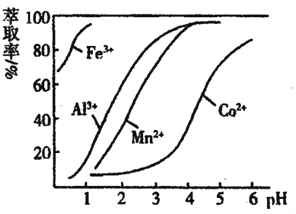
-
古“丝绸之路”我国商人运出的货物有:①丝绸 ②茶叶 ③白糖 ④瓷器 ⑤纸张 ⑥植物油⑦明矾 ⑧金银铜器等。下列说法正确的是
A. ④、⑦、⑧都属于盐类
B. ①、③、⑤、⑥都属于高分子化合物
C. ①、②、⑤、⑥都属于蛋白质
D. ①、②、③、⑤、⑥的主要成分都属于有机物
难度: 简单查看答案及解析
-
化学与生活密切相关,下列说法正确的是
A. 防腐剂是一种影响化学反应速率的食品添加剂
B. 高锰酸钾溶液、酒精、双氧水能杀菌消毒是利用了它们的强氧化性
C. 小苏打做糕点的膨松剂是由于NaHCO3能与碱反应
D. 维生素C对人体有益且人体不能合成,长期、大量服用有利于健康
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,3.4 g D2O2所含极性键数目为0.2NA
B. 25℃,pH =2的H2SO4溶液中,H+的数目为0.02 NA
C. 标准状况下,2.24 L CCl4含有的分子数目为0.1NA
D. lmol OH-含有的电子数目为10NA
难度: 中等查看答案及解析
-
下列对应化学反应的离子方程式中正确的是
A. 氧化钠投入水中:O2- +H2O =2OH-
B. FeCl3溶液与KI溶液反应:2Fe3+ +2KI= 2Fe2+ +I2 +2K+
C. 过量硫酸氢铵溶液与氢氧化钡溶液反应:Ba2+ +2OH- +SO42- +2H+ =BaSO4↓+2 H2O
D. 铜片投入稀硝酸:Cu +4H+ +NO3-= Cu2+ +NO2 ↑+2H2O
难度: 中等查看答案及解析
-
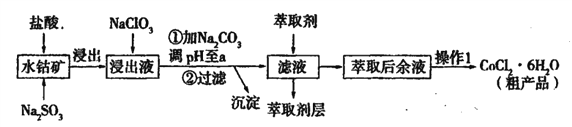
实验是化学研究的基础,关于下列各实验装置的叙述中,正确的是
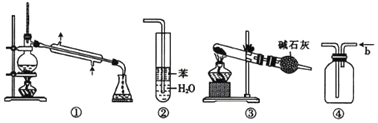
A. 装置①常用于分离互不相溶液体混合物
B. 装置②可用于吸收HCl气体,并防止倒吸
C. 以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D. 装置④b口进气排空气法可收集CO2、NO等气体
难度: 中等查看答案及解析
-
分子式为C7H7Cl,且分子中含有苯环的同分异构体有(不考虑立体结构)
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
樱桃是一种抗氧化的水果,其表现抗氧化性的一种有效成分M的结构简式如图:
 下列有关M的说法中不正确的是
下列有关M的说法中不正确的是A. M的分子式为C4H6O5
B. M中含有两种官能团,分别为羟基和羧基
C. 标准状况下,0.1 mol M完全燃烧时消耗6.72 L O2
D. 1mol M与足量金属钠反应生成3mol H2
难度: 中等查看答案及解析
-
下列反应类型相同的一组是
A. 乙烯使溴水褪色,乙醇使酸性高锰酸钾溶液褪色
B. 乙醇与浓硫酸共热至170℃,纤维素与浓硫酸共热
C. 乙酸乙酯水解生成乙醇,氯乙烷( C2H5Cl)水解成乙醇
D. 乙醇通过灼热的氧化铜粉末,石蜡油蒸汽通过灼热的碎瓷片
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 含有大量NO3-的溶液:H+、K+、Cl-、SO32-
B. 中性溶液:Fe3+、Al3+、NO3-、SO42-
C.
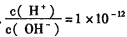 的溶液:K+、AlO2-、CO32-、Na+
的溶液:K+、AlO2-、CO32-、Na+D. 由水电离出的c(H+) =10-12mol/L的溶液:Na+、K+、CO32-、SO42-
难度: 困难查看答案及解析
-
下图为海水利用的部分过程。下列有关说法正确的是
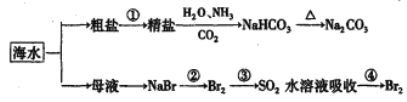
A. 粗盐提取精盐的过程只发生物理变化
B. 用澄清的石灰水可鉴别Na2CO3产品是否含有NaHCO3
C. 在第②、④步骤中,溴元素均被还原
D. 制取NaHCO3的反应是利用其溶解度小于NaCl
难度: 中等查看答案及解析
-
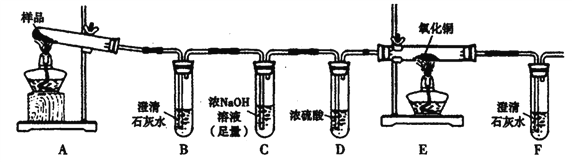
一种锂铜可充电电池,工作原理如图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法不正确的是
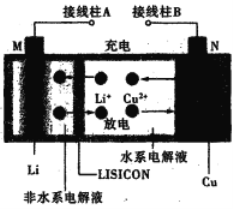
A. 陶瓷片允许Li+通过,不允许水分子通过
B. 放电时,N为电池的正极
C. 充电时,阴极反应为:Li+ +e-=Li
D. 充电时,接线柱A应与外接电源的正极相连
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. SiO2
SiCl4
Si
B. S
SO3
H2SO4
C. CaCO3
CaO
CaSiO3
D. NH3
NO
HNO3
难度: 中等查看答案及解析
-
下列实验方案能达到实验目的的是
实验目的
实验方案
A
检验Na2SO3晶体是否已氧化变质
将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成
B
证明酸性条件下H2O2氧化性强于I2
向淀粉KI溶液中滴入3滴稀硫酸,未见溶液变蓝;再加入10%的H2O2溶液,溶液立即变蓝色
C
制备氢氧化铁胶体
向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色
D
证明Mg(OH)2沉淀可转化为Fe(OH)3沉淀
向2 mL1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s) + CO2(g)
2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
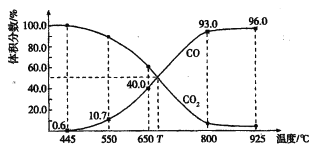
已知:气体分压(P分)=气体总压(p总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,V正、V逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为40.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= 23. 04p总
难度: 困难查看答案及解析
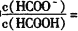 ___________。
___________。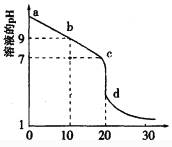
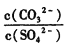 =___________(保留三位有效数字)。
=___________(保留三位有效数字)。