-
一定条件下,给水施加一个弱电场,常温常压下水瞬间结成冰,俗称“热冰”,下列关于“热冰”的叙述不正确的是( )
A.利用该性质,人们在常温常压下就可建溜冰场
B.“热冰”的密度比水小,是因为“热冰”中含有大量氢键的原故
C.水凝固为“热冰”所发生的变化为化学变化
D.采用弱电场的条件,说明水分子是极性分子难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.2molNO2与水反应转移电子数为NA
B.1.7gH2O2中含的电子数为0.9NA
C.1mol甲烷中的氢原子被氯原子完全取代,需要氯气分子数为2NA
D.pH=13的NaOH溶液含OH-的数目为0.1 NA难度: 中等查看答案及解析
-
实验室配制一种仅含四种离子(不包括水电离的离子)的无色混合溶液,且要求混合溶液中四种离子的浓度均相等,下列选项能达到要求的是( )
A.Cu2+、NH4+、SO42-、NO3-
B.Ca2+、Al3+、NO3-、Cl-
C.Na+、Mg2+、SO42-、I-
D.H+、HCO3-、K+、F-难度: 中等查看答案及解析
-
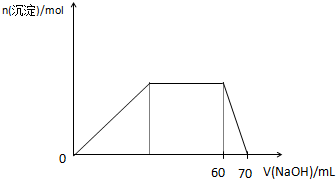
如下表除去杂质应选用的试剂或操作方法,正确的是( )
序号 物质 杂质 除杂质应选用的试剂或操作方法 A KNO3溶液 KOH 加入FeCl3溶液,并过滤 B FeCl3溶液 FeCl2 加入稍过量双氧水后放置 C CO O2 通过灼热的Cu网后收集气体 D K2CO3固体 NaHCO3 置于坩埚中加热
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
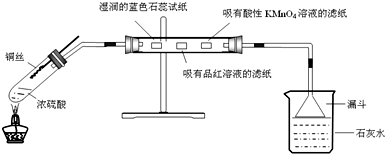
如图,木炭与浓硫酸共热产生的气体x和铜跟浓硝酸反应产生的气体y同时通入盛有过量M的洗气瓶中,下列说法正确的是( )

A.若M为BaCl2溶液,则洗气瓶中会产生BaCO3 和BaSO3沉淀
B.若M为Ba(OH)2溶液,洗气瓶中只会产生BaCO3沉淀
C.若M为KI淀粉溶液,洗气瓶中溶液一定会出现蓝色
D.若M为水,在z导管口有红棕色气体出现难度: 中等查看答案及解析
-
常温下,下列叙述不正确的是( )
A.pH=3弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性
B.pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO42-)与c(H+)之比约为1:10
C.0.1mol/L的Na2S溶液中粒子浓度关系:c(OH-)=c(HS-)+2c(H2S)+c(H+)
D.中和10mL 0.1mol/L 醋酸与100mL 0.01mol/L醋酸所需的NaOH物质的量不同难度: 中等查看答案及解析
-
爱迪生蓄电池在放电和充电时的反应为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列有关该电池的叙述中正确的是( )
A.放电时Fe作负极,放电时溶液中的阳离子向正极移动
B.充电时阳极的电极反应式为:Fe(OH)2+2e-═Fe+2OH-
C.充电时电池上标注“+”的电极应与外接电源的负极相连
D.该蓄电池可能用稀H2SO4作电解质溶液难度: 中等查看答案及解析
-
某浓度的硝酸与过量的铁粉反应生成标准状况下N2O气体4.48L.若改用铝粉反应(生成NO气体),则最终可溶解铝粉的质量为( )
A.8.9g
B.9.0g
C.13.5g
D.27.0g难度: 中等查看答案及解析