-
化学与生活密切相关,下列说法不正确的是
A. 次氯酸钠溶液可用作环境的杀菌消毒
B. 硅胶可用作商品包装袋的干燥剂
C. 爆竹燃放后,硫燃烧生成SO3
D. 施肥时,草木灰不能与胺态氮肥混合使用
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol甲基中含有电子数为10NA
B. 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA
C. 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA
D. 50mL12mol·L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A. 碱性:KOH>NaOH B. 金属性:Na>Al
C. 稳定性:HF>CH4 D. 酸性:HClO<HClO4
难度: 中等查看答案及解析
-
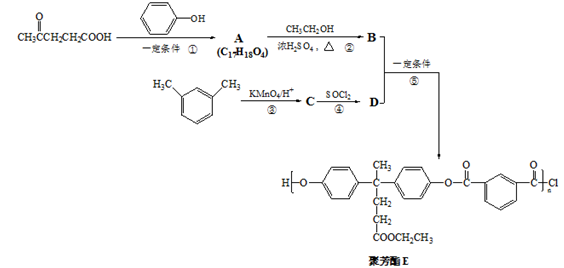
下列有关有机物的说法中
①结构片段为……
 ……的高聚物,其单体是甲醛和苯酚
……的高聚物,其单体是甲醛和苯酚②标准状况下,22.4LHF所含电子数约为10NA
③甲醇通常是一种有毒的气体,分子中只含极性键
④苯酚和碳酸钠溶液的反应:

⑤
 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
⑦等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
其中正确的有 个。
A. 4 B. 5 C. 6 D. 7
难度: 中等查看答案及解析
-
下列离子组在一定条件下能大量共存,且加入相应试剂后所对应的离子方程式正确的是
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
Fe2+、NO3-、K+
稀硫酸
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
B
Fe3+、I-、ClO-
氢氧化钠溶液
Fe3++3OH-=Fe(OH)3↓
C
Ba2+、HCO3-、Cl-
氢氧化钠溶液
HCO3-+ OH-=CO32-+H2O
D
Al3+、Cl-、NO3-
过量氢氧化钠液
Al3++3OH-=Al(OH)3↓
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列实验操作、现象和得出的结论均正确的是
选项
实验操作
现象
结论
A
向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN
溶液最终变为红色
原溶液中含有Fe3+
B
向浓度均为0.1mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
C
用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧
透过蓝色钴玻璃观察到火焰为紫色
原溶液中一定只含有K+
D
在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制Cu(OH)2
未见砖红色沉淀生成
淀粉未发生水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某温度下,向一定体积0.1mol·L-1的氨水中逐渐加入等浓度的盐酸,溶液中pOH [pOH=-lgc(OH-)]与pH的变化关系如下图所示.下列说法不正确是
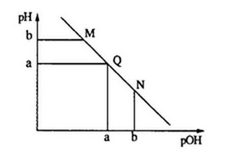
A. M点和N点溶液中H2O的电离程度相同
B. Q点溶液中,c(NH4+)+c(NH3·H2O)=c(Cl-)
C. M点溶液的导电性小于Q点溶液的导电性
D. N点溶液加水稀释,
变小
难度: 困难查看答案及解析
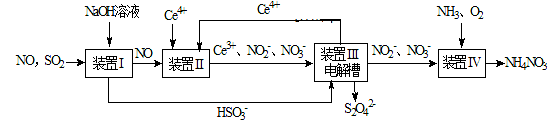
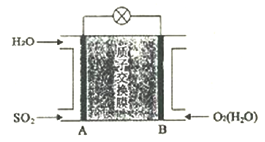
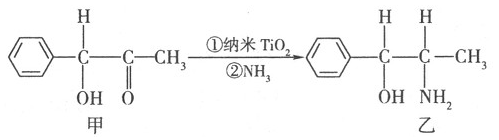
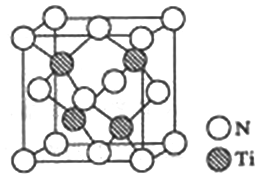
 (R、R′表示烃基)
(R、R′表示烃基)