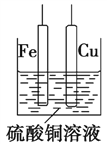
-
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸
HX
HY
HZ
电离常数K/(mol·L-1)
9×10-7
9×10-6
1×10-2
A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HZ+Y-===HY+Z-能够发生
C. 由电离平衡常数可以判断,HZ属于强酸,HX和HY属于弱酸
D. 相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX溶液的电离常数
难度: 中等查看答案及解析
-
下列实验操作和数据记录都正确的是
A. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
B. 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50 mL
C. 用10 mL量筒量取8.25 mL盐酸
D. 用pH试纸测得某溶液pH为3.2
难度: 简单查看答案及解析
-
美国亚利桑那州大学和阿贡国家实验室的科学家最近设计出生产氢气的人造树叶,原理为2H2O(g)
2H2(g)+O2(g)。有关该反应的说法正确的是( )
A. ΔH<0 B. ΔS<0
C. 化学能转变为电能 D. 氢能是理想的绿色能源
难度: 简单查看答案及解析
-
物质的量浓度相同的下列溶液中,含粒子种类最多的是
A.CaCl2 B.CH3COONa C.NH3 D.K2S
难度: 简单查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是( )
A.
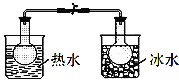 NO2球浸在热水和冰水中
NO2球浸在热水和冰水中B.

C.

D.
难度: 中等查看答案及解析
-
在2L容器中发生反应N2+3H2
2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol /(L·s),则这段时间为
A. 6 s B. 4 s C. 3 s D. 2 s
难度: 中等查看答案及解析
-
如图装置放置一段时间后,铁钉均被腐蚀。下列有关描述不正确的是( )
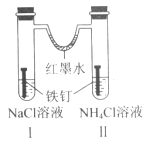
A.红墨水水柱两边的液面变为左低右高
B.I 和Ⅱ中负极反应式均为 Fe-2e-=Fe2+
C.I 中正极反应式为 O2+2H2O+4e-=4OH
D.Ⅱ中 NH4Cl 溶液里有气泡产生
难度: 中等查看答案及解析
-
取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )
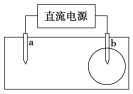
A.b电极是阴极
B.a电极与电源的正极相连
C.电解过程中水是氧化剂
D.b电极附近溶液的pH变小
难度: 中等查看答案及解析
-
相同物质的量浓度的NaCN和NaClO溶液相比,前者的pH较大,则下列有关同温、同体积和同浓度的HCN和HClO叙述中,正确的是
A.酸性:HCN>HClO
B.pH:HClO>HCN
C.浓度:c(CN-)<c(ClO-)
D.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
难度: 中等查看答案及解析
-
在1.5L的密闭容器中通入2moIN2和3molH2的混合气体,在一定温度下发生反应。达到平衡时,容器内压强为反应开始时的0.8倍,则该反应的化学平衡常数为( )
A. 0.34 B. 0.64 C. 0.44 D. 0.54
难度: 困难查看答案及解析