-
由A和B两种盐组成的混合物,进行了下列实验:
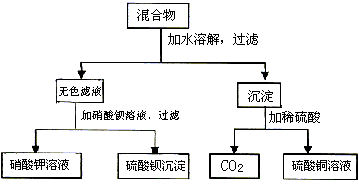
试判断,A、B分别是________。
写出实验过程中加水时时发生反应的离子方程式________。
难度: 简单查看答案及解析
如果你家里的食用花生油混有水份,你将采用下列何种方法分离
A.过滤 B.蒸馏 C.分液 D.萃取
难度: 简单查看答案及解析
下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A.①和② B.①和③ C.③和④ D.①和④
难度: 简单查看答案及解析
下列物质中属于氧化物的是
A.O2 B.Na2O C.NaClO D.FeSO4
难度: 简单查看答案及解析
下列说法正确的是
A.电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离
B.强电解质与弱电解质的本质区别,是其水溶液导电性的减弱
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.常见的强酸、强碱和大部分盐都是强电解质,其他化合物都是非电解质
难度: 简单查看答案及解析
下列物质的水溶液能导电,但属于非电解质的是 ( )
A.Na2S B. Cl2 C. NaHCO3 D. CO2
难度: 简单查看答案及解析
能用H++OH- = H2O表示的是 ( )
A.NaOH溶液和CO2的反应 B.Ba(OH)2溶液和稀H2SO4的反应
C.NaOH溶液和盐酸反应 D.氨水和稀H2SO4的反应
难度: 简单查看答案及解析
在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.K+ 、MnO4-、Na+、Cl- B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42- D.Fe3+、Na+、Cl-、SO42-
难度: 简单查看答案及解析
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤
正确的操作顺序是
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
难度: 简单查看答案及解析
下列叙述正确的是
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
难度: 简单查看答案及解析
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是
A.16g B.32g C.64g /mol D.32g /mol
难度: 简单查看答案及解析
科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是
A.原子数 B.分子数 C.体积 D.物质的量
难度: 简单查看答案及解析
同温同压下,等质量的下列气体所占有的体积最大的是
A.O2 B.CH4 C.CO2 D.SO2
难度: 简单查看答案及解析
用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有的分子数为1 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,1 NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol·/L的MgCl2溶液中,含有Cl- 个数为1 NA
难度: 简单查看答案及解析
欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A.①② B.②③ C.①③ D.①②③
难度: 简单查看答案及解析
下列反应的离子方程式书写正确的是
A.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu
B.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-=BaSO4↓
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
难度: 简单查看答案及解析
在无色透明溶液中,不能大量共存的离子组是
A.Cu2+、Na+、SO42-、Cl- B.K+、Na+、HCO3-、NO3-
C.OH-、HCO3-、Ca2+、Na+ D.Ba2+、Na+、OH-、NO3-
难度: 简单查看答案及解析
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、OH-、Cl- B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ba2+、HCO3-、NO3-、K+
难度: 简单查看答案及解析
下列叙述正确的是
A.固体氯化钠不导电,所以氯化钠是非电解质
B.铜丝能导电,所以铜是电解质
C.氯化氢水溶液能导电,所以氯化氢是电解质
D.SO3溶于水能导电,所以SO3是电解质
难度: 简单查看答案及解析
甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是
A.甲一定是氢氧化钙溶液 B.乙一定是硝酸钾溶液
C.丙不可能是碳酸钠溶液 D.丁只能是盐酸
难度: 简单查看答案及解析
下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是
A.NaHCO3与Ca (OH)2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.Ca(HCO3)2与NaOH
难度: 简单查看答案及解析
(1)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是________;R的相对原子质量约是________。
(2)0.5 mol H2O的质量为 ________,其中含有________个水分子,共有________个原子。
(3)配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O ____ g。
难度: 简单查看答案及解析
下列物质: ⑴Na⑵ Br2 ⑶Na2O ⑷NO2 ⑸CO2 ⑹ SO3 ⑺NH3 ⑻H2S ⑼HCl ⑽ H2SO4 ⑾Ba(OH)2 ⑿NaCl ⒀蔗糖 ⒁NaCl溶液。
(1)属于电解质的是________ ,(2)属于非电解质的是 ________,
(3)能导电的是________。
难度: 简单查看答案及解析
写出下列物质的电离方程式:
NaHSO4________,
K2SO4________,
NH4NO3。
难度: 简单查看答案及解析
胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:________;
如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是:________;
此时最好用含氢氧化稆的胃药(如胃舒平)离子方程式:________。
难度: 简单查看答案及解析
用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,请按要求填空:
⑴所需浓H2SO4的体积为________。
⑵如果实验室有10mL、20mL、50mL量筒,应选用________mL量筒,实验中还需要用到的仪器有烧杯、玻璃棒、________、500mL容量瓶。
⑶若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容________。
②定容时俯视刻度线________。
⑷若定容时液面高于刻度线应采取的措施是。
难度: 简单查看答案及解析
由A和B两种盐组成的混合物,进行了下列实验:

试判断,A、B分别是________。
写出实验过程中加水时时发生反应的离子方程式________。
难度: 简单查看答案及解析