-
导致下列环境问题的主要原因与排放SO2有关的是
A. 酸雨 B. 光化学烟雾 C. 臭氧层空洞 D. 温室效应
难度: 简单查看答案及解析
-
关于氯气的叙述中,下列正确的是
A. 氯气不能溶解于水,所以可用排水法收集氯气
B. 氯气在自然界中既可以以化合态存在,也可以以游离态存在
C. 氯气是一种黄绿色、有毒的气体
D. 氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
难度: 简单查看答案及解析
-
下列说法正确的是
A. 硫粉在过量的纯氧中燃烧可以生成大量的SO3
B. 可以用澄清石灰水溶液鉴别SO2和CO2
C. SO2能使品红溶液、酸性KMnO4溶液褪色,但褪色原理不同
D. 少量SO2通过浓CaCl2的溶液能生成白色沉淀
难度: 简单查看答案及解析
-
下列有关化学用语使用正确的是
A. 硫原子的原子结构示意图:
B. NH4Br的电子式:
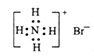
C. CO2的电子式:
D. H2O2的结构式: H-O-O-H
难度: 简单查看答案及解析
-
下列说法正确的是
A. 医疗上使用的131I和127I互为同位素
B. C、N、O的最高正价依次升高,对应气态氢化物稳定性依次增强
C. aA2+、bB+、cC-三种离子具有相同的电子层结构,则原子序数c>a>b
D. P、S、Cl原子半径依次减小,对应含氧酸的酸性依次增强
难度: 简单查看答案及解析
-
近20年来,稳定同位素分析法在植物生理学、生态学和环竟科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、 18O、34S等常用做环境分析指示物。下列说法中正确的是
A. 34S原子核内的中子数为16 B. 16O转换成18O不是化学变化
C. 2H+的酸性比1H+的酸性更强 D. 13C和15N的质子数相差2
难度: 简单查看答案及解析
-
下列物质中含有共价键的离子化合物是( )
A. Ba(OH)2 B. CaCl2 C. H2O D. H2
难度: 中等查看答案及解析
-
下列各组中化合物的性质比较,不正确的是
A. 酸性: HClO4> HBrO4> HIO4 B. 碱性: NaOH> Mg(OH)2> Al(OH)3
C. 稳定性: PH3>H2S> HCl D. 非金属性: F>O>S
难度: 中等查看答案及解析
-
下列有关碱金属元素的叙述正确的是( )
A. 碱金属单质均为银白色,密度均小于水
B. 碱金属单质从Li到Cs,熔点依次升高
C. 氢氧化铯碱性强于氢氧化钠
D. 碱金属元素形成的阳离子,从Li+到Cs+氧化性依次增强
难度: 中等查看答案及解析
-
已知: ①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸;③S2-易被氯气氧化;④氯化氢比硫化氢稳定;⑤盐酸是强酸,氢硫酸是弱酸。上述叙述中可说明氯元素比硫元素非金属性强的是
A. ①②③ B. ②③④ C. ③④⑤ D. ①⑤
难度: 简单查看答案及解析
-
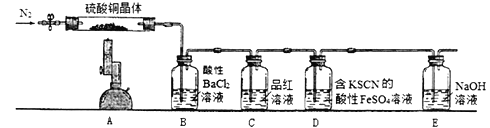
在如下图的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是 ( )
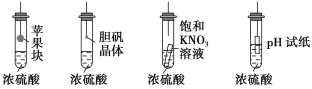
A.苹果块会干瘪 B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出 D.pH试纸变红
难度: 中等查看答案及解析
-
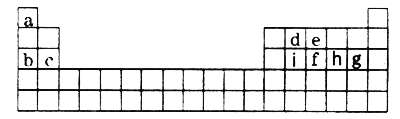
a、b、c、d为原子序数依次增大的短周期主族元素,其中b、c的单质在化学反应中只能作还原剂,a、d同主族且二者均可形成常温常压下为气态的氢化物,下列说法一定正确的是
A. a、b的氢化物的化学键类型相同
B. a、 d的最高化合价一定相同
C. 简单离子半径: b>c
D. b、c、d最高价氧化物对应的水化物两两间能发生反应
难度: 中等查看答案及解析
-
X、Y、Z、M、W为原子序数依次增大的5种短周期元素。 X的质子总数与电子层数相同,Y、Z、M同周期且和邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族的短周期元素可形成常见的导致酸雨的气体甲。X、Y、Z3种元素形成化合物乙。下列说法错误的是
A. 气体甲可使品红褪色
B. 化合物乙中一定只有共价健
C. W元素的某种单质可在电子工业用于生产半导体材料
D. X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM
难度: 简单查看答案及解析
-
下列变化过程中,原物质内仅有共价键被破坏,同时有离子键形成的是( )
A. 盐酸和NaOH溶液反应
B. 氯化氢溶于水
C. 稀硫酸与BaCl2溶液反应
D. 氯化氢与氨气反应生成NH4Cl固体
难度: 中等查看答案及解析
-
X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是
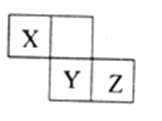
A. 化合物XZ3中各原子均满足8电子的稳定结构
B. X、Y、Z三种元素形成的含氧酸都是强酸
C. 常温下,Z单质可与Y的氢化物发生置换反应
D. 一定条件下,X2与Al反应得到AlX
难度: 简单查看答案及解析
-
下列实验中,固体物质可以完全溶解的是
A. lmolMnO2 与含4molHCl的浓盐酸共热 B. lmolCu 与含2molH2SO4的浓硫酸共热
C. lmolCu 投入含4molHNO3的浓硝酸中 D. 常温下1mol铝片投入到足量浓硝酸中
难度: 简单查看答案及解析
-
A、B、C、 D、E是原子序数依次增大的五种短周期主族元素,其中A元素的一种同位素用于考古时测定一些文物的年代,B、D位于周期表的同一主族,B的最外层电子数是次外层电子数的三倍,C元素的最高价氧化物对应的水化物是一种中强碱,下列叙述错误的是
A. lmolA元素的最高价氧化物的共用电了对数目为4NA
B. 离子半径: r(C)>r(D)>r(E)>r(B)
C. 0.05mol/L的D的最高价氧化物的水化物的溶液其c(H+)=0.1mol/L
D. C元素分别与B、E元素组成得到化合物在熔融状态下均能导电
难度: 简单查看答案及解析
-
某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与l00mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g、FeCl20.425mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. l00mL的盐酸中HC1物质的量浓度为7.5mol/L
B. 生成的H2S气体在标准状况下的体积为2.24L
C. 该磁黄铁矿中FexS的x=0.85
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3:1
难度: 困难查看答案及解析