-
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济要求的是
A.发展氢能和太阳能 B.举行“地球一小时”熄灯活动
C.限制塑料制品的使用 D.种植农作物时大量使用化肥和农药
难度: 简单查看答案及解析
-
下列说法正确的是
A.阳离子只有氧化性,阴离子只有还原性
B.失电子难的原子获得电子的能力一定强
C.得到电子越多的氧化剂,其氧化性就越强
D.要实现Fe2+→Fe3+的转化,必须加入氧化剂
难度: 简单查看答案及解析
-
下列各组离子在给定条件下一定能大量共存的是
A.使pH试纸显蓝色的溶液中:
Fe3+、NO3-、SO42-
B.含有大量NO3-的溶液中:NH4+、I-、SO2-4、H+
C.加入Al能放出H2的溶液中:Cl-、SO2-4、NO3-、Mg2+
D.在c(H+)=1.0×10-13mol·L-1的溶液中:Na+、SO2-4、[Al(OH)4]-、K+
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,11.2LO2参加反应转移的电子数一定为2NA
B.用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023
C.0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
D.28gN2和CO的混合气体中含有的分子数为NA
难度: 简单查看答案及解析
-
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是
A.根据纯净物中的元素组成,将纯净物分为单质和化合物
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类
难度: 简单查看答案及解析
-
下列说法正确的是
A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因
B.N、P、As的非金属性逐渐增强
C.因为氧化性HClO>稀H2SO4,所以非金属性Cl>S
D.钠原子在反应中失去的电子比铝原子少,故钠的金属性应弱于铝
难度: 简单查看答案及解析
-
下列说法中,正确的是
A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
B.KsP越小,难溶电解质在水中的溶解能力一定越弱
C.KsP的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同
难度: 简单查看答案及解析
-
下列有关实验原理、方法和结论都正确的是
A.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶,除去干燥的CO2中混有的少量SO2
D.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
难度: 简单查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲是由其中的三种元素组成的化合物,0.1mol·L-1甲溶液的pH为13(25℃),Y元素最低负化合价的绝对值与其原子最外层电子数相等,下列说法正确的是
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第IVA族
C.与氢气化合时,Z比Y容易
D.甲中只含有离子键
难度: 简单查看答案及解析
-
某同学对下列四个实验都设计了两种方案,其中两种方案均合理的是
选项
A
B
C
D
实验
目的
除去碳酸钠中少量的碳酸氢钠
清洗铁制品
表面的铁锈
检验苯中
含有少量甲苯
鉴别二氧化氮
和溴蒸汽
方案1
溶解后加入盐酸
加适量稀盐酸
加入Br2/CCl4
加水
方案2
加热
用水洗涤
加入酸性KMnO4
加压
难度: 简单查看答案及解析
-
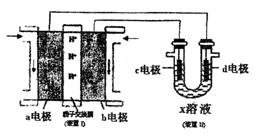
利用下图装置探究铁在海水中的电化学防护。下列说法不正确的是

A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁极的反应:Fe=Fe2++2e-
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁极的反应:2H++2e-=H2↑
难度: 简单查看答案及解析
-
钯的化合物氯化钯可用来检测有毒气体CO,常温发生反应的化学方程式为:
CO+PdCl2+H2O=CO2+Pd↓+2HCl下列说法正确的是
A.氧化性:PdCl2>CO2 B.反应中PdCl2被氧化
C.生成22.4LCO2时,转移的电子为2mol D.CO气体只有在高温下才能表现还原性
难度: 简单查看答案及解析
-
下列实验“操作和现象”与“结论”都正确的是
操作和现象
结论
A
切开金属钠,钠表面的银白色会逐渐褪去
Na在空气中会生成Na2O2
B
铝箔插入浓硝酸中,无明显现象
铝与浓硝酸不反应
C
SO2通入酸性KMnO4溶液,溶液褪色
SO2具有漂白性
D
将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的2/3处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管
从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示
难度: 简单查看答案及解析
-
已知A、B为单质,C为化合物。能实现上述转化关系的是

①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A. ①② B. ③④ C. ①③ D. ②④
难度: 简单查看答案及解析
-
下列离子方程式书写不正确的是
A.向H2SO4酸化的KI溶液中滴加H2O2:2I-+H2O2+2H+=I2+2H2O
B.小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑
C.氯气溶于水:Cl2+H2O
H++Cl-+HClO
D.检验溴乙烷中含有的溴元素:CH3CH2Br+Ag+=AgBr↓+CH3CH2+
难度: 简单查看答案及解析
-
“茶倍健”牙膏中含有茶多酚,期中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是

A.分子式为C15H12O7
B.EGC可在强碱的醇溶液中发生消去反应
C.1molEGC最多消耗6molNaOH
D.1molEGC可与4molBr2发生取代反应
难度: 简单查看答案及解析
-
下列叙述正确的是
A.醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)<c(Na+)
难度: 简单查看答案及解析
-
取两个相同容积的密闭恒容容器,在A容器中充入0.2molN2O4,B容器中充入0.2molHI气体,在一定温度下反应分别达到平衡,测得N2O4和HI的分解率分别为a(A)和a(B)。在该平衡体系中再分别充入0.2molN2O4和0.2molHI,当反应重新达到平衡时,测得N2O4和HI的分解率分别为a′(A)和a′(B)。下列判断一定正确的是
A.a(A)>a′(A) a(B)<a′(B) B. a(A)>a′(A) a(B)= a′(B)
C.a(A)<a′(A) a(B)<a′(B) D. a(A)= a′(A) a(B)>a′(B)
难度: 简单查看答案及解析