-
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )。
A. 1∶4 B. 1∶2
C. 2∶1 D. 4∶1
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 一定温度和压强下,各种气态物质体积的大小主要由构成气体的分子大小决定
B. 一定温度和压强下,各种气态物质体积的大小主要由构成气体的分子数决定
C. 不同的气体,若体积不同,它们所含的分子数一定不同
D. 同温同压下,同体积的任何气体单质所含的原子数相同
难度: 简单查看答案及解析
-
假若你是卫生防疫人员,为配制0.01 mol·L-1的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是( )
A. 取KMnO4样品时不慎在表面沾了点蒸馏水
B. 溶解搅拌时有液体飞溅出
C. 定容时俯视容量瓶刻度线
D. 摇匀后见液面下降,再加水至刻度线
难度: 中等查看答案及解析
-
同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是( )
A. 所含分子数和质量均不相同]
B. 含有相同的分子数和电子数
C. 含有相同的质子数和中子数
D. 含有相同数目的中子、原子和分子
难度: 中等查看答案及解析
-
物质分类的依据通常有组成和性质。下列物质分类中,只考虑组成的是( )
A. Na2SO4是钠盐、硫酸盐、正盐
B. HNO3是一元酸、强酸、挥发性酸
C. Mg(OH)2是二元碱、难溶性碱、中强碱
D. Al2O3是两性氧化物、金属氧化物、最高价氧化物
难度: 简单查看答案及解析
-
生产生活中的许多现象或应用都与化学知识有关。下列现象或应用与胶体性质无关的是
A. 将盐卤或石膏加入豆浆中,制成豆腐
B. 冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3溶液混合后,喷出大量泡沫,起到灭火作用
D. 清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象
难度: 简单查看答案及解析
-
下列物质中属于纯净物的是( )
①由同种元素组成的物质 ②具有固定熔沸点的物质 ③由相同种类和相同数目的原子组成的分子 ④只有一种元素的阳离子和另一种元素的阴离子组成的物质 ⑤在氧气中燃烧只生成二氧化碳的物 ⑥只含有一种分子的物质
A. ②③⑥ B. ④⑤⑥ C. ①④ D. ②⑥
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 阳离子只有氧化性,阴离子只有还原性
B. 失电子难的原子获得电子的能力一定强
C. 得到电子越多的氧化剂,其氧化性就越强
D. 要实现Fe2+到Fe3+的转化,必须加入氧化剂
难度: 中等查看答案及解析
-
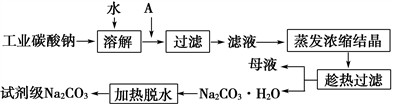
物质R2CO3的饱和溶液V mL,密度为ρ g·cm-3,c(R+)=P mol·L-1,溶质的质量分数为a%,溶质的摩尔质量为M g·mol-1,溶质的溶解度为S g。则下列表达式正确的是
A. a=
B. S=
C. P=
×2 D. V×ρ×a%=
难度: 困难查看答案及解析
-
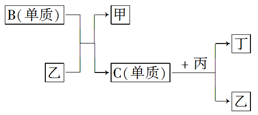
已知某物质X能发生如下转化:
,下列有关上述转化关系中物质及其反应的叙述不正确的是( )
A. 若X为N2或NH3,则A为硝酸
B. 若X为S或H2S,则A为硫酸
C. 若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D. 反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 根据反应Cu+H2SO4
CuSO4+H2↑可推知Cu的还原性比H2的强
B. 在反应CaH2+2H2O===Ca(OH)2+2H2↑中,水作氧化剂
C. 反应3NO2+H2O===2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1
D. Cl2的氧化性强于I2的氧化性,故置换反应I2+2NaClO3===2NaIO3+Cl2不能发生
难度: 中等查看答案及解析
-
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,物质的量浓度为c mol·L-1,则下列选项不正确的是( )
A. 溶质的质量分数为w=
B. 用水稀释该溶液,OH-的物质的量增加
C. 该溶液中共有6种微粒
D. 上述溶液中再加入V
mL水后,所得溶液溶质的质量分数大于0.5w
难度: 中等查看答案及解析
-
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是( )
A. 反应中硫元素被氧化,所有铁元素均被还原
B. 氧化剂是Fe3+,氧化产物是Cu2+
C. 反应中转移电子的物质的量为x mol
D. 反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol
难度: 困难查看答案及解析
-
把100 mL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A. 20(2b-a) mol·L-1 B. 20(b-2a) mol·L-1
C. 10(2b-a) mol·L-1 D. 10(b-2a) mol·L-1
难度: 中等查看答案及解析
-
根据表中信息,判断下列叙述中正确的是( )
序号
氧化剂
还原剂
其他反应物
氧化产物
还原产物
①
Cl2
FeBr2
/
Fe3+、Br2
②
KClO3
浓盐酸
/
Cl2
③
KMnO4
H2O2
H2SO4
O2
Mn2+
A. 由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同
B. 反应①中,当只有少量Cl2时,反应可表示为Cl2+ Fe2+===Fe3++ 2Cl-
C. 表中②组反应的还原产物是KCl,电子转移数目是6e-
D. 表中③组反应的离子方程式为2MnO
+ 3H2O2+6H+===2Mn2++ 4O2↑+ 6H2O
难度: 中等查看答案及解析
-
下列离子组一定
能大量共存的是( )
A. 甲基橙呈黄色的溶液中:I-、Cl-、NO
、Na+
B. 石蕊呈蓝色的溶液中:Na+、AlO
、NO
、HCO
C. 含大量Al3+的溶液中:K+、NO
、Na+、ClO-
D. 含大量OH-的溶液中:CO
、Cl-、F-、K+
难度: 中等查看答案及解析
-
下列有关NaClO和NaCl混合溶液的叙述正确的是( )
A. 该溶液中,H+、NH
、SO
、Br-可以大量共存
B. 该溶液中,Ag+、K+、NO
、CH3CHO可以大量共存
C. 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+===Cl-+2Fe3++H2O
D. 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
难度: 中等查看答案及解析
-
对下列反应:①NH4HCO3溶液与石灰水反应、②K2SO3溶液与稀盐酸反应,③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是( )
A. ①②③ B. ①②④
C. ①③④ D. ②③④
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液
均有固体析出
蛋白质均发生变性
B
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X中一定含有SO
C
向一定浓度的Na2SiO3溶液中通入适量CO2气体
出现白色沉淀
H2SiO3的酸性比H2CO3的酸性强
D
向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)> Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
以下六种饱和溶液①Ba(NO3)2 ②Ca(OH)2 ③Na2SiO3 ④NaAlO2 ⑤Na2CO3 ⑥ NH3和NaCl,分别持续通入CO2,最终得到沉淀或析出晶体的是 ( )
A. ①③④⑥ B. ②③④⑥ C. ③④⑤⑥ D. ②③④⑤
难度: 中等查看答案及解析
-
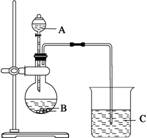
右图是某同学设计的储气装置(固定装置已略去),下列说法中,不正确的是 ( )

A. 打开止水夹a、b,气体从d管导入,储存在下面的集气瓶里
B. 气体被储存在下面的集气瓶里时,c导管也必须安装止水夹
C. 取用储存在下面集气瓶里的气体时,通过控制止水夹a、b,可将气体顺利排出
D. 该装置也可作为制取二氧化碳气体的发生装置
难度: 中等查看答案及解析
-
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是 ( )
A. 合金的熔点一般比组分金属低
B. 铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na)
C. 铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出
D. 若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小
难度: 中等查看答案及解析
-
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
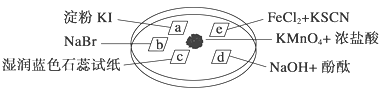
对实验现象的“解释或结论”正确的是 ( )
选项
实验现象
解释或结论
A
a处变蓝,b处变红棕色
氧化性:Cl2>Br2>I2
B
c处先变红,后褪色
氯气与水生成了酸性物质
C
d处立即褪色
氯气与水生成了漂白性物质
D
e处变红色
还原性:Fe2+>Cl-
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列有关氧化还原反应的说法正确的是 ( )
A. 浓盐酸在化学反应中既可以作氧化剂,又可以作还原剂
B. 工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化
C. 在任何条件下都不能发生反应:Cu + H2SO4=CuSO4+ H2↑
D. 亚氯酸可发生分解反应:HClO2
ClO2↑+Cl2↑+H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol
难度: 中等查看答案及解析
-
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO
、N2、Cl-六种粒子反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是

A. 还原剂是CN-,氧化产物只有N2
B. 氧化剂是ClO-,还原产物是HCO
C. 配平后氧化剂与还原剂的计量数之比为5∶2
D. 标准状况下若生成2.24 L N2,则转移电子0.5 mol
难度: 中等查看答案及解析