-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 28克乙烯和丙烯的混合气体的分子数为NA
B. 标准状况下,22.4升CCl4的分子数为NA
C. 30克C2H6中,共价键的数目为7NA
D. 1 mol苯分子中含有的碳碳单键的数目为6NA
难度: 中等查看答案及解析
-
1 g O2 含有m 个分子,则阿伏加德罗常数的数值可表示为
A. m/32 B. m C. 32m D. m/16
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是(
A. 显蓝色的淀粉溶液中通入足量SO2后变成无色溶液:I2+SO2+2H2O=2I-+SO42-+4H+
B. 电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO+CO2+H2O=2HC1O+CO32-
C. NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
D. FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl
难度: 中等查看答案及解析
-
常温下,各组离子在指定溶液中一定能大量共存的是
①加入A1能产生H2的溶液:Na+、K+、NO3-、Cl-
②水电离产生的c(H+)=10-12mol/L的溶液:HCO3-、Na+、K+、NO3-
③在含有大量Fe3+的溶液中:HCO3-、Ca2+、Na+、SCN-
④与NH4HCO3反应能产生气体的溶液:Na+、K+、NO3-、Cl-
⑤使石蕊变红的溶液中:Fe2+、NO3-、MnO4-、Na+
⑥无色溶液中:Cu2+、K+、NO3-、Br-
A. ④ B. ②⑥ C. ③⑤ D. ①④
难度: 困难查看答案及解析
-
下列反应中属于氧化还原反应,但水既不做氧化剂,又不做还原剂的是
A.ICl+H2O=HCl+HIO B.2Na2O2+2H2O=4NaOH+O2
C.2F2+2H2O=4HF+O2 D.2K+2H2O=2KOH+H2↑
难度: 简单查看答案及解析
-
下列判断正确的是( )
①维生素C具有还原性,在人体内起抗氧化作用
②NO2溶于水时发生氧化还原反应
③1 mol Cl2参加反应转移电子数一定为2NA
④阴离子都只有还原性
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
向稀氨水中加入下列物质,能使溶液中的铵根离子浓度减小、pH增大的是
A.水 B.氨气 C.氢氧化钠固体 D.氯化铵固体
难度: 中等查看答案及解析
-
下列叙述中一定正确的是
A.任何浓度溶液的酸碱性都可用pH试纸测定
B.某温度下,pH=6.2的纯水显酸性
C.25℃时,pH=1的醋酸溶液中c(H+)是pH=2的盐酸溶液中c(H+)的10倍
D.25℃时,pH=12的NaOH溶液中的n(OH-)=10-2mol
难度: 中等查看答案及解析
-
下列实验装置图合理的是
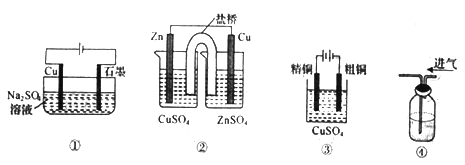
A. 装置①可实现:Cu+2H2O
Cu(OH)2+H2↑
B. 装置②能构成锌铜原电池
C. 装置③可用于粗铜的电解精炼
D. 装置④可用于浓硫酸干燥氯气
难度: 中等查看答案及解析
-
用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是
A. 稀NaOH溶液 B. HCl溶液
C. NaCl溶液 D. 酸性AgNO3溶液
难度: 简单查看答案及解析
-
利用下列实验装置进行相应的实验(部分夹持装置略去),不能达到实验目的的是
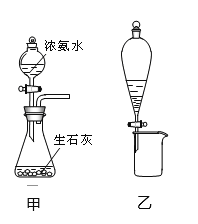
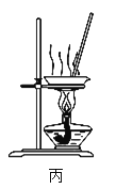

A. 利用图甲装置可快速制取少量氨气 B. 利用图乙装置分离水和溴的苯溶液
C. 利用图丙装置蒸发KCl溶液得晶体 D. 图丁装置中溶液颜色变浅,说明SO2具有漂白性
难度: 中等查看答案及解析
-
某强酸性溶液X中仅含有H+、NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离和离子的水解),取该溶液进行连续实验,实验过程如下:

下列有关推断合理的是
A. 根据上述连续实验不能确定溶液X中是否含有Fe3+
B. 沉淀H为Al(OH)3、BaCO3的混合物
C. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
D. 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05mol·L-1
难度: 困难查看答案及解析
-
下列冶炼金属的原理正确的是( )
A. 电解食盐水制备金属钠 B. 加热分解Cu2O制备金属铜
C. 用A12O3与CO热还原法制备单质铝 D. 湿法炼铜是用铁和硫酸铜溶液反应
难度: 中等查看答案及解析
-
下列推断正确的是
A. N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B. 向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C. 可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D. 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
难度: 中等查看答案及解析
-
下列各项叙述中正确的是
A. 同一原子中,能层序数越大,s 原子轨道的形状相同,半径越大
B. 在同一能层上运动的电子,其自旋方向肯定不同
C. 镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态
D. 一个分子中只有参与形成σ键、π键的价电子以及内层电子,没有其他类型的电子
难度: 中等查看答案及解析
-
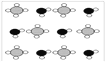
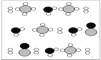
下列电子排布图能表示基态氮原子的是 ( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 多电子原子中,在离核较近的区域内运动的电子能量较高
B. 原子核外电子的数目越多,电子的运动状态就越多
C. 轨道表示式,是对原子核外电子运动状态最完美的描述
D. 所有元素原子的最外层电子数都等于该元素的最高化合价
难度: 中等查看答案及解析
-
有6种物质:①甲烷 ②苯 ③聚乙烯 ④乙烯 ⑤丙烯 ⑥己烷 ,既能使酸性高锰酸钾溶液褪色又能与溴水起加成反应使之褪色的是 ( )
A. ③④⑤ B. ④⑤⑥ C. ④⑤ D. ③④⑤⑥
难度: 中等查看答案及解析
-
有机物①C2H6 ②C2H4 ③C2H2 ④C6H6它们分子中的碳碳键键长由大到小排列顺序正确的是
A. ①>②>③>④ B. ①>④>②>③
C. ④>②>①>③ D. ④>①>②>③
难度: 简单查看答案及解析
-
下列醇可以发生消去反应且所得产物无同分异构体的是
A.
 B.
B. 
C. CH3OH D.

难度: 简单查看答案及解析
-
丙烯醛的结构简式为CH2=CHCHO ,下列有关其性质的叙述不正确的是( )
A.能使溴水褪色
B.能与过量的氢气充分反应生成丙醛
C.能发生银镜反应
D.能被新制的氢氧化铜悬浊液氧化
难度: 中等查看答案及解析
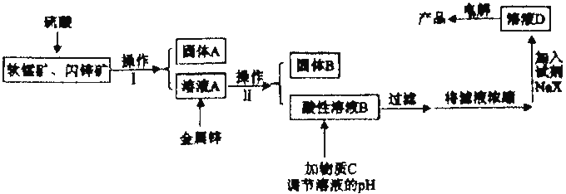
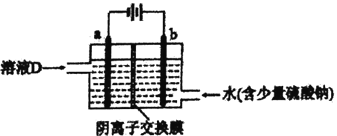
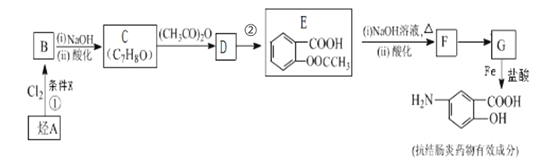
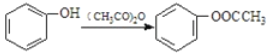 ②
②
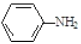 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A 为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A 为原料合成化合物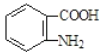 的合成路线_______________
的合成路线_______________