-
设阿伏加德罗常数的数值为NA,下列说法正确的是
A. 1 molCl2与足量Fe反应,转移的电子数为3NA
B. 1.5 mol NO2与足量H2O反应,转移的电子数为1.5NA
C. 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA
D. 0.10 mo Na2O2粉末与足量水反应生成的O2分子数为0.10NA
难度: 简单查看答案及解析
-
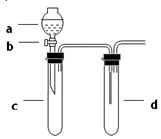
用固体样品配制—定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是
A.
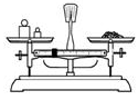 称量 B.
称量 B. 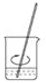 溶解 C.
溶解 C. 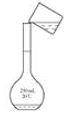 转移溶液 D.
转移溶液 D.  定容
定容难度: 中等查看答案及解析
-
下列关于离子共存或离子反应的说法正确的是
A. 某无色溶液中可能大量存在H+、Cl-、MnO4-
B. pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C. Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D. 稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
选项
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中有SO42-
B
滴加氯水和CCl4,振荡、静置
下层溶液显紫色
原溶液中有I-
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+,无K+
D
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于元素周期律和元素周期表的说法错误的是
A. Na、Mg、Al元素的原子核外电子层数随着核电荷数的增加而增加
B. 第2周期元素从Li到F,元素原子得电子能力逐渐增强
C. 同一周期从左到右,随着元素原子序数的递增,其气态氢化物的稳定性增强
D. C、N、O、F的单质与H2化合越来越容易
难度: 简单查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A. 原子序数 d>c>b>a
B. 原子半径:r(A)>r(B)>r(D)>r(C)
C. 单质的还原性:A>B>D>C
D. 离子半径:r(C3-)> r(D-)> r(B+)> r(A2+)
难度: 中等查看答案及解析
-
下列能说明氯原子得电子能力比硫原子强的是
①HC1的溶解度比H2S大
②HC1的酸性比H2S强
③HCl的稳定性比H2S强
④HC1的还原性比H2S强
⑤HC1O的酸性比H2SO4强
A. ①②⑤ B. ③④ C. ③ D. ①②③④⑤
难度: 中等查看答案及解析
-
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是
A. A→F,ΔH=-ΔH6
B. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C. C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|
D. |ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
难度: 简单查看答案及解析
-
反应:2H2(g)+O2(g)===2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )
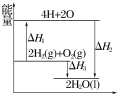
A.ΔH1<0 B.ΔH2为该反应的反应热
C.ΔH3不是H2的燃烧热 D.ΔH2=ΔH1+ΔH3
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是
A. 吸热反应中,新化学键形成吸收能量;放热反应中,新化学键形成放出能量
B. 等质量的硫蒸气和硫磺(S)分别完全燃烧,后者放出的热量多
C. 相同体积、浓度均为0.1 mol/L的盐酸和醋酸溶液分别与足量的NaOH稀溶液反应,前者放出热量多
D. 氢气的燃烧热为285. 8 kJ·mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(l) △H=-285.8 kJ·mol-1
难度: 中等查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法正确的是
A. CO和O生成CO2是吸热反应
B. 在该过程中,CO断键形成C和O
C. CO和O生成了具有极性共价键的CO2
D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
难度: 困难查看答案及解析
-
已知:①Fe2O3(s)+3C(s) ===2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+1/2O2(g) ===CO2(g) ΔH=-283 kJ·mol-1
③C(s)+1/2O2(g)===CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3(s)+3C(s)+ 3/2O2(g) ===2Fe(s)+3CO2(g)的焓变是
A. -355 kJ B. +355 kJ C. -355 kJ • mol-1 D. +355 kJ • mol-1
难度: 中等查看答案及解析
-
已知:①C(s)+H2O(g)=CO(g)+H2(g) ΔH=-akJ·mol-1
②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol−1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462kJ•mol−1,则a为
A. -332 B. -118 C. +350 D. -130
难度: 中等查看答案及解析
-
在一定容积的密闭容器中进行反应:N2(g)+3H2(g)
 2NH3(g)。已知反应过程中某一时刻N2,H2,NH3的浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。当反应达到平衡时,可能存在的数据是
2NH3(g)。已知反应过程中某一时刻N2,H2,NH3的浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。当反应达到平衡时,可能存在的数据是A. N2为0.2mol/L,H2为0.6mol/L
B. N2为0.15mol/L
C. N2,H2均为0.18mol/L
D. NH3为0.4mol/L
难度: 简单查看答案及解析
-
已知:(CH3COOH)2
2CH3COOOH,实验测得不同压强下体系平均相对分子质量(
) 随温度(T)变化曲线如图所示。下列说法正确的是
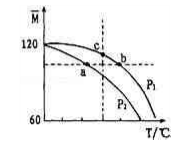
A. 该过程△H<0
B. 平衡常数:K (a) =K (b) <K (c)
C. 气体压强:p (a) <p (b) =p (c)
D. 当
=80 时,n[(CH3COOH)2]:nCH3COOH =1: 1
难度: 中等查看答案及解析
-
在恒容密闭容器中,CO与H2发生反应CO(g)+2H2(g)
CH3OH(g) △H<0,达到平衡后,若只改变某一条件,下列示意图正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
FeCl3溶液与KSCN溶液混合时存在下列平衡:Fe3+(aq)+SCN-( aq)
Fe(SCN)2+(aq) 已知某一条件下,反应达到平衡时,Fe(SCN)2+的物质的量浓度与温度的关系如图所示,下列说法正确的是
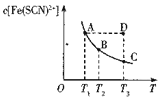
A.该反应为吸热反应
B.T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
C.反应处于D点时,一定有v正大于v逆
D.A点的c(Fe3+)比B点的c(Fe3+)大
难度: 中等查看答案及解析
-
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)
4NO2(g)+O2(g)△H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s
0
500
1000
1500
c(N2O5)mol/L
5.00
3.53
2.50
2.50
下列说法中不正确的是:
A. T1温度下,500s时O2的浓度为0.74mol/L
B. 平衡后其他件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5)>5.00 mol/L
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D. T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为0.5
难度: 中等查看答案及解析
-
为了探索外界条件对反应aX(g)+bY(g)
cZ(g)的影响,以X和Y的物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。以下判断正确的是
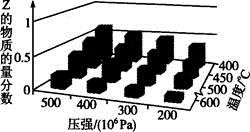
A. △H>0,a+b>c B. △H>0,a+b<c
C. △H<0,a+b>c D. △H<0,a+b<c
难度: 中等查看答案及解析
-
粗硅提纯常见方法之一是先将粗硅与HCl反应制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)
Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
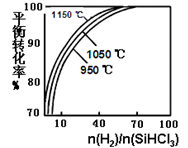
A. X是H2
B. 1150℃反应的平衡常数大于950℃时反应的平衡常数
C. 减小Si(s)的量,有利于提高SiHCl3的转化率
D. 工业上可采用增大压强的方法提高产率
难度: 中等查看答案及解析